 а)
а)
УДК 612.112:613.81
* г. Тула, Тульский
государственный педагогический университет им. Л.Н.Толстого
** 142292, г. Пущино Московской обл., Институт биофизики клетки РАН; тел.: (095) 923-96-68 доб. 315;
факс: (0967) 79-05-09
Действие этанола на нервные клетки изучено достаточно подробно. Среди наиболее важных последствий метаболизма экзогенного алкоголя выделяют: возникновение гипервосстановленности клеток, нарушения в обмене белков, углеводов и липидов, образование токсичного ацетальдегида и некоторых других соединений [1-3]. В то же время, несмотря на исключительно важную роль клеток иммунной системы в жизнедеятельности организма, их реакция на воздействие алкоголя исследована недостаточно [2, 4, 5].
В связи с этим целью данной работы было установление
характера и механизма изменений функционирования клеток иммунной
системы при остром воздействии этанола в сравнении с клетками
нервной системы. Основной акцент сделан на мембранотропный эффект
алкоголя [2], который наблюдали по изменению продукции активных
форм кислорода (АФК) нейтрофилами под воздействием активаторов
различного типа [5-9] с помощью метода хемилюминесцентного анализа.
Биологический объект. Работа выполнена на перитонеальных вызванных нейтрофилах мышей-самцов аутбредной линии NMRI, полученных из вивария барьерного типа лаборатории линейных животных филиала Института биоорганической химии им. акад. М.М. Шемякина и акад. Ю.А. Овчинникова. Средний вес экспериментальных животных составлял 25-30 г. Выделение перитонеальных нейтрофилов проводили по стандартной методике [10]. Полученные клетки ресуспендировали в среде 199 и хранили при +4оС с постоянным перемешиванием. Нейтрофилы в суспензии составляли более 85% всех клеток.
Реактивы и растворы. Зимозан, люминол, форбол-12-миристат-13-ацетат (ФМА), хемотаксический пептид N-формил-метионил-лейцил-фенилаланин (ФМЛФ), среда 199 и раствор Хенкса (Sigma, США). Физиологический раствор для регистрации хемилюминесценции (в мМ): 138 NaCl, 6 KCl, 1 MgSO4, 1 Na2HPO4, 5 NaHCO3, 5,5 глюкозы, 1 CaCl2, 0,35 люминола, 10 HEPES/NaOH; pH = 7.4. Спирт технический этиловый 96%-ный, водка Русская и водка Левша - производства АО Туласпирт ТЛВЗ, самогон 40%-ный.
Измерение хемилюминесценции нейтрофилов. Продукцию АФК нейтрофилами при их активации ФМА (1 мкМ) или ФМЛФ (10 мкМ) оценивали по люминолзависимой хемилюминесценции (ХЛ-Л), измеряемой по известной методике [11]. ХЛ-Л регистрировали хемилюминометром ХЛ-111М, изготовленным в лаборатории биофизики нервной клетки Института биофизики клетки РАН. Конструкция прибора позволяла регистрировать ХЛ-Л последовательно в 12 рабочих ячейках, термостатируемых при 370,1оC. Время опроса всех 12 ячеек составляло 10 с при активации нейтрофилов ФМА и 3 с - при активации ФМЛФ.
Непосредственно перед началом эксперимента клетки
распределяли по ячейкам, заполненным физиологическим раствором
(20 мкл суспензии клеток на ячейку с общим рабочим объемом
200 мкл). Плотность нейтрофилов в ячейке составляла около
106 клеток/мл. В каждой серии независимых экспериментов
3 ячейки использовали в качестве контроля, оставшиеся 9 - для
исследования действия этанола (по 3 ячейки на каждую концентрацию).
В течение первых 1-2 минут регистрировали интенсивность спонтанной
ХЛ-Л. Затем в ячейки добавляли спирт определенной концентрации
и инкубировали в течение 2,5 минут, после чего вносили активирующий
агент и продолжали запись уровня ХЛ-Л в течение необходимого времени.
Съем данных и дальнейшую их обработку осуществляли с помощью IBM
PC и пакета специализированных программ Luminometer. Суммарную
продукцию АФК оценивали пропорционально площади под кривой зависимости
ХЛ-Л от времени [10]. За нулевой уровень принимали среднюю интенсивность
спонтанной ХЛ-Л, за начало отсчета - момент подачи активирующего
агента и считали площадь под кривой за выбранное время. Для дальнейшего
анализа усредняли полученные значения суммарной продукции АФК,
а отличие контроля от опыта оценивали как разность усредненных
значений в контроле и в опыте, соотнесенную к контролю и выраженную
в процентах. Статистический анализ данных проводили по t-критерию
Стьюдента. Достоверность результатов оценивали по границам доверительного
интервала с вероятностью p > 0,95.
В первую очередь необходимо было установить пороговые концентрации этанола для нейтрофилов и оптимальное время действия алкоголя на клетки. Предварительные эксперименты показали, что при инкубации нейтрофилов в среде 0,4%-ного спирта наблюдается ингибирование продукции АФК, зависящее от времени экспозиции (табл.1). Из данных таблицы следует, что наиболее воспроизводимые результаты получаются при экспозиции нейтрофилов в среде 0,4%-ного спирта в течение 2,5 и 5 минут. Во всех последующих опытах респираторный взрыв нейтрофилов инициировали через 2,5 минуты после добавления спирта к суспензии клеток.
Таблица 1
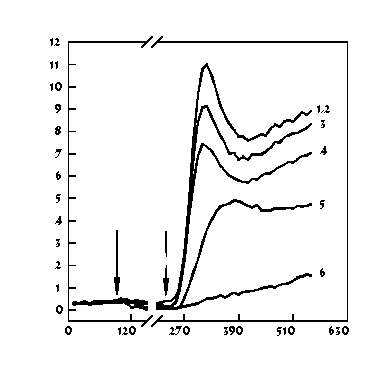
Если в качестве активатора респираторного взрыва использовался ФМА, пороговая концентрация этанола, начиная с которой достоверно определяется изменение уровня ХЛ-Л, находится около 0,4% (рис. 1а). При активации клеток ФМЛФ пороговой является концентрация этанола около 0,1% (рис.1б). При этом 50%-ная степень ингибирования продукции АФК наблюдалась при концентрации спирта 1,4% для ФМА и 0,62% для ФМЛФ (рис. 2).
 а)
а)
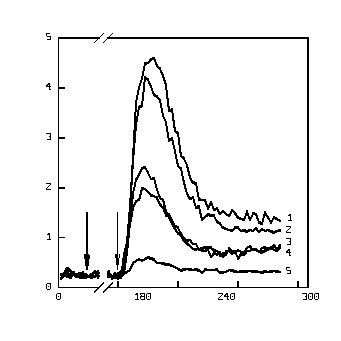 б)
б)
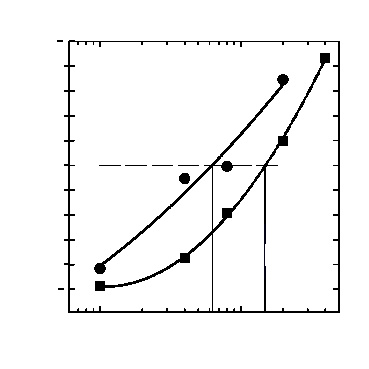
Ингибирование продукции АФК в ходе проведенных экспериментов может быть вызвано либо снижением активности мембраносвязанной НАДФН-оксидазы, либо уменьшением концентрации активных форм кислорода вследствие их перехвата этиловым спиртом, который при этом может окисляться до ацетальдегида. Во втором случае результаты экспериментов должны быть аналогичны независимо от типа использованного активатора. Однако наши данные обнаруживают заметные различия при активации клеток ФМА и ФМЛФ (рис. 2). Так, 50%-ное ингибирование продукции АФК реактивом ФМЛФ достигается при концентрации этанола в 2 раза более низкой, чем в случае использования ФМА.
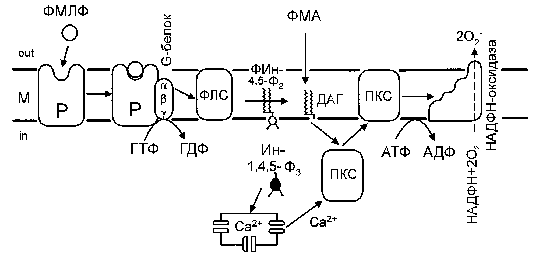
При обсуждении механизма ингибирования респираторного взрыва экзогенным этанолом, по-видимому, необходимо принимать во внимание разжижающее действие спирта на мембраны клеток, в результате которого ослабляются гидрофобные взаимодействия. Мембрана становится менее структурированной. В таких условиях нарушаются кооперативные взаимодействия между мембраносвязанными белками, участвующими в трансдукции рецепторного сигнала (рис. 3). В результате конформационные изменения этих белков уже не отражаются в полной мере на конечном участке цепи - активном центре НАДФН-оксидазы, что приводит к снижению активности данного фермента. При этом ингибирование продукции АФК будет тем сильнее, чем больше последовательных звеньев передачи сигнала задействовано при использовании конкретного активатора. Препарат ФМА, встраиваясь в плазматическую мембрану, непосредственно активирует протеинкиназу С, которая осуществляет фосфорилирование НАДФН-оксидазы. Т. е. действие ФМА опосредовано только протеинкиназой С. Препарат ФМЛФ взаимодействует со специфическим рецептором, и в передаче рецепторного сигнала в этом случае участвуют все звенья последовательной цепи (рис. 3). В итоге ингибирующий эффект экзогенного этанола суммируется на этих звеньях, и степень фосфорилирования НАДФН-оксидазы оказывается меньше, что и отражается в снижении продукции супероксидного аниона.
Мы проверили, достаточна ли чувствительность клеток иммунной системы для обнаружения различий в спиртах разного качества. Для этой цели были использованы водки Русская, Левша и самогон, содержащий 40% этанола. В этих экспериментах в качестве активатора респираторного взрыва использовали ФМЛФ. Оказалось, что водки по своему действию на функциональную активность клеток близки к ранее изученному спирту, тогда как ингибирующее действие самогона выражено гораздо сильнее (рис. 4). Скорее всего это связано с высоким содержанием в нем сивушных масел (800 мг/л в самогоне (выражаем благодарность аналитической лаборатории АО НИПИМ г. Тула за проведенный анализ сивушных масел в исследуемом самогоне), 3 мг/л в водке Левша и 8 мг/л в водке Русская [12]). Последние, являясь высшими изо-спиртами, вероятно, в большей степени снижают кооперативное взаимодействие между последовательными звеньями трансдукции рецепторного сигнала.
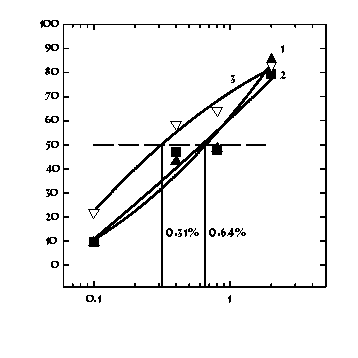
Таким образом, хемилюминесцентный анализ продукции
АФК при активации респираторного взрыва нейтрофилов ФМЛФ позволяет
определить качество спиртосодержащих продуктов по их действию
на клетки иммунной системы.
1. Алкоголизм. (Руководство для врачей) / Под ред. Г.В. Морозова, В.Е. Рожнова, Э.А. Бабаяна.- М., 1983.
2. Буров Ю.В., Ведерникова Н.Н. Нейрохимия и фармакология алкоголизма.- М., 1985.
3. Груздева К.Н., Высокогорский В.Е. // В кн.: Биологические основы алкоголизма / Под ред. Г.В. Морозова.- М., 1984.- С. 59-64.
4. Евсеев Б.А. // В кн.: Биологические основы алкоголизма / Под ред. Г.В. Морозова.- М., 1984.- С.187-194.
5. Patel M., Keshavarzian A., Badie B. et al. // Alcohol.- Clin. Exp. Res.- 1996.- Vol. 20.- ¦ 2.- P. 275-283.
6. Badwey I.A., Karnovski M.L. // Cur. Top. Cell. Regul.- 1986.- Vol. 28.- P.183-209.
7. Brom C., Brom I., Konig W. // Immunol.- 1991.- Vol. 73.- P. 287-292.
8. Smith D.C. // J. Biol. Chem.- 1985.- Vol. 260.- ¦ 25.- P. 5875-5878.
9. Wolfson M., McPhail L., Nasrallah V., Snyderman R. // J. Immunol.- 1985.- Vol.135.- P. 2057-2062.
10. Гапеев А.Б., Сафронова В.Г., Чемерис Н.К., Фесенко Е.Е. // Биофизика.- 1996.- Т. 41.- Вып.1.- С. 205-219.
11. Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных. Итоги науки и техники.- М.: ВИНИТИ, 1989.- Т. 24.- 176 с.
12. ГОСТ 12712-80.
Ethanol concentrations were determined at which inhibition
of production of reactive oxygen species by mouse neutrophils
during respiratory burst was found. On the base of the results
obtained using different activators, the mechanism of the inhibition
was suggested. Using of FMLP as the respiratory burst activator
allows to distinguish alcohols of different degree of purification
by their influence on immune system cells.