УДК 616.36
300026, Тула, пр. Ленина, 108, НИИ новых медицинских технологий; тел./факс: (0872) 33-22-09;
E-mail: niinmt@mednet.com
Печень представляет собой самый крупный полифункциональный орган, который одновременно является эндокринной и экзокринной железой, а также центральным органом, поддерживающим гомеостаз. В печени создается единый обменный и энергетический пул для метаболизма белков, жиров, углеводов, витаминов, гормонов, осуществляются пигментный обмен и детоксикация. Все функции печени тесно взаимосвязаны между собой, и изменение либо выпадение одной из них приводит к нарушениям остальных функций. Следствием этих функциональных нарушений является развитие печеночной недостаточности [3].
Печеночная недостаточность может развиться в результате воздействия на печень любых факторов, повреждающих гепатоциты. Изучению взаимосвязи функциональных нарушений печени с тяжестью морфологических изменений гепатоцитов и ткани печени в целом посвящено немало работ [1, 3, 8, 12]. Однако в настоящее время среди ученых-гепа-тологов отсутствует единая точка зрения на значение морфологических изменений различной степени тяжести в развитии тех или иных функциональных нарушений. Существуют крайне противоположные мнения по поводу зависимости развития печеночной недостаточности от тяжести поражения гепатоцитов. Так, автор [3] считает, что развитие печеночной недостаточности имеет место уже при незначительных и обратимых изменениях в виде зернистой и жировой дистрофии гепатоцитов. По мнению [1, 3, 5], тяжесть функциональных нарушений, а, соответственно, и клинические признаки печеночной недостаточности коррелируют с выраженностью морфологических изменений: от латентной - при зернистой и жировой дистрофии - до явных клинических проявлений, включая развитие печеночной энцефалопатии, при тяжелых некротических процессах. Наряду с этим имеются данные о том, что в ряде случаев признаки печеночной недостаточности могут отсутствовать либо быть незначительными даже при крайне тяжелых морфологических изменениях ткани печени, таких как хронический активный гепатит (ХАГ) и цирроз печени (ЦП) [5, 12], что во многом определяется регенераторной активностью гепатоцитов.
Так, по мнению [3], острая печеночная недостаточность с клиническими явлениями печеночной энцефалопатии и переходом ее в печеночную кому возможна только при поражении 75%-80% паренхимы печени. Вместе с тем, по данным гепатэктомии, были получены результаты, свидетельствующие о том, что в ряде случаев печень способна сохранить свои функции и поддерживать гомеостаз при удалении 80% ее паренхимы [5]. Недостаточно изучена роль фибропластических процессов в развитии дистрофии и некроза гепатоцитов, их взаимосвязь между собой, а, соответственно, и значение для возникновения дисфункции печени. Сложилось мнение, согласно которому нередко фибропластические процессы в печеночной ткани рассматриваются как легкие морфологические изменения, не представляющие опасности формирования печеночной недостаточности.
Противоречивость и обилие точек зрения на роль различных по тяжести морфологических изменений в развитии печеночной недостаточности во многом объясняется тем, что патологические процессы в печени нередко рассматриваются без учета особенностей этиологии и генеза изучаемой патологии. Подавляющее большинство исследований, посвященных этой проблеме, проводились на светооптическом уровне, с использованием рутинных методов (окраска гематоксилином и эозином и по ван Гизону). В большинстве случаев эти исследования носят сугубо описательный характер. Крайне мало работ посвящено изучению ультраструктурных изменений в гепатоцитах и их взаимосвязи с тяжестью функциональных нарушений печени, в то же время именно ультраструктурные изменения наиболее полно и отчетливо отражают метаболические нарушения в гепатоцитах. В связи с этим, является актуальным исследование ультраструктурных изменений гепатоцитов, а также выявление взаимосвязи тяжести функциональных нарушений с воздействием этиологических факторов, обладающих гепатотропным эффектом.
Материалом для исследования послужила ткань печени
при желчнокаменной болезни (ЖКБ) как одной из наиболее спорных
в этиологическом и патогенетическом отношениях патологии. По данным
Всемирной организации здравоохранения, 20% женщин и 8% мужчин
старше 50 лет страдают желчнокаменной болезнью. Вопрос о роли
первичного поражения паренхимы печени в формировании холелитиаза
начал обсуждаться сравнительно недавно. С 70-х годов появились
работы, указывающие на то, что тяжесть повреждения гепатоцитов
отражается на составе печеночной желчи и структуре желчных камней
[2, 4, 7]. Однако параллельно существует точка зрения, согласно
которой морфологические изменения в печени при ЖКБ рассматриваются
как результат желчной гипертензии и гнойного холангита и зависят
от длительности заболевания, частоты приступов печеночной колики,
степени воспаления желчного пузыря [10]. Практически не рассматривается
вопрос о возможной этиологической и патогенетической связи ЖКБ
с действием на печень других гепатотропных агентов и, в первую
очередь, вируса гепатита В. В настоящее время в мире насчитывается
более 200 миллионов носителей HBsAg, количество их постоянно увеличивается,
что представляет колоссальный резервуар HBV-инфекции. На долю
вирусного гепатита В приходится до 75% всех хронических заболеваний
печени [1]. В связи с этим является актуальным исследование роли
хронических заболеваний печени в формировании холелитиаза и, в
частности, изучение значения ультраструктурных изменений гепатоцитов.
Цели исследования заключаются в изучении особенностей
ультраструктурных изменений гепатоцитов при ЖКБ с учетом процессов,
обусловленных поражением печени вирусом гепатита В; в выявлении
их взаимосвязи с метаболическими нарушениями, включая изменения
синтеза желчи и ее транспорта за пределы гепатоцита; в установлении
значения тяжести ультраструктурных изменений гепатоцитов в патогенезе
формирования функциональных нарушений печени.
Для достижения поставленных целей проведено исследование ультраструктурных изменений в гепатоцитах у 30 больных желчнокаменной болезнью, включая 15 больных, перенесших вирусный гепатит В, у которых в ткани печени выявлена персистенция HBsAg.
Взятие материала для исследования осуществлялось
на базе Тульской областной больницы в эндоскопическом отделении
и частично - в отделении общей хирургии Пермской областной клинической
больницы. Биопсия печени осуществлялась во время холецистэктомии.
Материал фиксировался в 1% глютаральдегиде с последующей дофиксацией
в 1% четырехокиси осмия и проводкой по спиртам. Фиксированная
и обезвоженная ткань пропитывалась в смеси ацетон - смола и заливалась
в среду, состоящую из смеси эпона 812 и аралдита. Ультратонкие
срезы получали на ультрамикротоме марки ЛКБ III (данная часть
работы выполнена на базе лаборатории электронной микроскопии Университета
дружбы народов). Электронно-микроскопические исследования проводились
в лаборатории электронной микроскопии Тульского государственного
университета.
При изучении ткани печени на ультраструктурном уровне, у всех больных с персистенцией HBsAg обнаружены изменения субклеточных структур. В первую очередь изменениям были подвержены наиболее уязвимые ультраструктуры, ответственные за энергетический обмен и белковосинтетическую функцию. Характерными ультраструктурными изменениями гепатоцитов во всех случаях являлись гиперплазия и полиморфизм митохондрий, которые имели нечеткие, размытые кристы; гладкая и шероховатая эндоплазматическая сеть (ЭПС) резко гиперплазирована, расширена с формированием вакуолей и потерей рибосом. В матриксе содержится большое количество полисом и свободных рибосом (рис. 1). Значительные изменения митохондрий и ЭПС свидетельствуют о значительном нарушении энергообеспечения метаболических процессов, протекающих в гепатоцитах. На фоне указанных ультраструктурных изменений преобладало угнетение белковосинтетической функции. О чем свидетельствует наличие у этих больных биохимического синдрома гепатоцеллюлярной недостаточности. Наблюдалось снижение содержания альбуминов (70 2 г/л), альбумино-глобулиновый коэффициент составил менее 0,8 преимущественно за счет снижения альбуминов, а при наличии хронического активного гепатита (ХАГ) - и за счет повышения содержания глобулиновой фракции. Угнетение белковосинтетической функции коррелировало с тяжестью ультраструктурных изменений: от незначительного снижения альбуминов на фоне слабо выраженных дистрофических изменений до выраженной гипоальбуминемии в сочетании c гипофибринемией при тяжелых ультраструктурных изменениях, обусловленных хроническим активным гепатитом и циррозом печени вирусной этиологии. У 3 больных с морфологическими диагнозами ХАГ и ЦП наблюдался геморрагический синдром, обусловленный снижением синтеза в печени коагулянтов и, в первую очередь, фибриногена (1,85 0,5 г/л).

Функционально-морфологические признаки нарушения белковообразующей функции гепатоцитов закономерно сочетались с ультраструктурными и биохимическими изменениями, свидетельствующими об угнетении энергетического обмена в гепатоцитах. На фоне выраженного полиморфизма митохондрий, расширения и деструкции гладкой ЭПС в матриксе имелись обширные поля гликогена (рис. 2). Вместе с тем, содержание глюкозы в цельной капиллярной крови у этих больных было снижено и составило (3,2 ммоль/л), что подтверждает наличие ферментативной и энергетической блокады углеводного обмена на уровне гепатоцита. Отмечено, что блокада углеводного обмена, сопровождающаяся накоплением в гепатоцитах большого количества гликогена, наблюдалась преимущественно у больных с морфологическим диагнозом ХАГ.
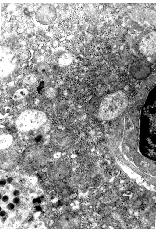
Эти данные подтверждают снижение утилизации гликогена в гепатоцитах при хронических воспалительных заболеваниях печени и совпадают с результатами, полученными ранее в работах [6, 11].
Нарушение утилизации гликогена в еще большей степени способствует угнетению процессов энергообеспечения и приводит к замыканию порочного круга в цепи патогенеза повреждения гепатоцитов. Тяжесть метаболических нарушений в гепатоцитах подтверждается наличием изменений со стороны ядер. Во всех случаях выявлены расширение перинуклеарного пространства и маргинация хроматина. Встречались ядра неправильной формы, с ундуляцией ядерной мембраны (рис. 3).
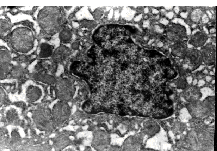
Непосредственными ультраструктурными проявлениями нарушения желчеобразования и желчевыделения являются изменения билиарных полюсов гепатоцитов, на которых выявлена деструкция микроворсинок, желчные капилляры расширены и заполнены мицеллами желчи (рис. 4). Обращает на себя внимание аномальное распределение мицелл желчи по цитоплазме гепатоцитов, которое характеризовалось их скоплением на апикальных полюсах. Этот факт подтверждает предположение о возможном активном транспорте желчи через апикальный полюс в условиях внутриклеточного холестаза [14]. Биохимический анализ крови показал наличие на фоне указанных изменений синдрома холестаза, кото-рый сопровождался повышением уровня как прямого (7,3 1,5), так непрямого билирубина (20,3 2,3).
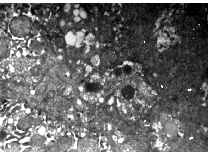
Тяжелые морфо-функциональные изменения спровоцированы воспалительными и фибропластическими изменениями в печеночной ткани, которые непосредственно связаны с хроническим поражением HBV и подтверждается наличием HBsAg. Наблюдается пролиферация и активация купферовских клеток, обнаружены множественные контакты активных лимфоцитов с мембраной и проникновение их в цитоплазму гепатоцитов. Синусоиды резко расширены с гипертрофией микроворсинок. Характерна массивная коллагенизация синусоидов и наличие коллагеновых волокон в цитоплазме гепатоцитов (рис. 5).
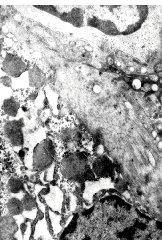
На ультраструктурном уровне были выявлены начальные этапы фибропластического процесса: волокна коллагена свободно располагаются в просвете синусоида и по ходу эндотелиальной выстилки. Коллагенообразование преимущественно происходит в резко расширенных синусоидах, что закономерно сопровождается застойными явлениями, гипоксией ткани печени и, в свою очередь, стимулирует функцию фибробластов, способствуя развитию фибропластических процессов (рис. 6).
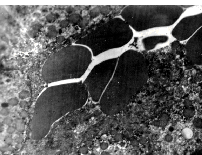
Воспалительный процесс, коллагенизация синусоидов и гипоксия неизбежно ведут к тяжелым некробиотическим изменениям в гепатоцитах. Ультраструктурные изменения при этом характеризуются деструкцией гладкой и шероховатой эндоплазматической сети, уменьшением количества митохондрий, полиморфизмом ядер, маргинацией хроматина, ундуляцией ядерной мембраны, которая имеет нечеткие контуры, и расширением перинуклеарного пространства (рис. 6). Указанные ультраструктурные изменения закономерно сопровождаются преобладанием биохимического синдрома цитолиза [8]. По мере нарастания некробиотических процессов, биохимические изменения в крови сопровождались значительным повышением трансаминаз (АЛТ - 0,8 0,5 мкмоль (ч х мл), ЛДГ - 6,0 1,0 мкмоль (ч х мл)), общего билирубина - 38,5 3,2 мкмоль/л, преимущественно за счет непрямой фракции (20,5 3,5 мкмоль/л), резким снижением содер-жания альбуминов (30 1,5 г/л) и фибриноге-на (1,8 0,5 г/л). Обращает на себя внимание тот факт, что во всех случаях на фоне выраженных некробиотических процессов наблюдаются ультраструктурные изменения, обуславливающие нарушения желчеобразования и желчевыделения, тяжесть которых не зависела от присутствия желчной гипертензии во внепеченочных желчных протоках.
В ткани печени 5 больных с морфологическим диагнозом
ХАГ и ненарушенным оттоком желчи по холедоху, изменения со стороны
билиарных полюсов гепатоцитов не отличались от таковых при обтурации
камнями внепочечных желчных путей. При этом наряду с массивным
внутриклеточным холестазом и деструкцией микроворсинок наблюдалось
значительное расширение желчных капилляров и скопление в них желчи
в виде желчных озер. Отсутствие механического препятствия оттоку
желчи во внепеченочных желчных путях подтверждено данными клинического
и интраоперационного обследования. В этой группе больных единичные
камни локализовались в желчном пузыре, при проходимости папилл
желтуха и приступы печеночной колики отсутствовали. Камни были
выявлены при рентгенологическом и ультразвуковом обследовании
больных, течение заболевания у которых соответствовало хроническому
активному гепатиту.
Полученные результаты показывают, что у больных
ЖКБ при наличии поражения печени гепатотропными агентами, в частности
вирусом гепатита В, в первую очередь изменяются наиболее уязвимые
ультраструктуры: ЭПС и митохондрий, что сказывается на белковообразующей
функции и энергетическом обмене в гепатоцитах. Указанные ультраструктурные
изменения находят отражение в биохимическом синдроме гепатоцеллюлярной
недостаточности, который коррелируется с тяжестью морфологических
изменений. Нарушения желчеобразования и желчевыделения проявляется
внутриклеточным холестазом, который вначале может не сопровождаться
повышением уровня билирубина в крови. Прогрессирование ультраструктурных
изменений закономерно приводит к нарушению процессов желчеобразования
и желчевыделения, морфологическим отражением которых является
вначале накопление большого количества мицелл желчи, их перераспределение
по цитоплазме гепатоцитов, а затем - изменения на билиарных полюсах
в виде деструкции микроворсинок, расширения желчных капилляров
и обтурацией их мицеллами желчи. Учитывая, что указанные морфологические
изменения наблюдаются на фоне отсутствия обтурации холедоха, следует
предположить блокаду желчеобразования в печеночных клетках, которая
обусловлена воздействием на печень гепатотропных агентов и ведет
к синтезу литогенной желчи. Прогрессированию данного процесса
способствуют воспалительные и фибропластические изменения в ткани
печени, а также формирование подпеченочного холестаза. По мере
развития некробиотических процессов наблюдается резкое нарастание
синдрома холестаза, причем помимо прямой фракции, значительно
повышается содержание непрямого билирубина, что еще раз указывает
на нарушение метаболизма желчи непосредственно в гепатоцитах и
подтверждает первичную роль печени в процессе литогенеза.
1. Блюгер А.Ф., Новицкий И.Н. Практическая гепатология, Рига: Звайгзне, 1984.- 405 с.
2. Вагнер Е.А., Палатова Л.Ф., Урман М.Г. Морфология печени и химический состав камней при ЖКБ // Желчнокаменная болезнь. Материалы Всесоюзного симпозиума.- Душанбе: Дониш, 1981.-С. 12-14.
3. Гальперин Э.И. Печеночная недостаточность.- М.: Медицина, 1987.- 294 с.
4. Жукова М.Ю. Морфологические аспекты желчеобразования в ряду позвоночных. Автореф. дисс... канд. мед. наук.- Иркутск, 1990.- 18 с.
5. Журавлев В.А. Большие и предельно большие резекции печени.- Саратов, 1986.- 197 с.
6. Кривчик А.А., Гринько И.В., Зиновкина В.Ю., Рачков Л.В. Общие закономерности электронно-микроскопических изменений субклеточных структур гепатоцитов в ходе развития разных форм патологии печени // Морфология органов и систем.- Минск, 1990.- С. 75-79.
7. Озеров В.Ф., Слобожанкин А.Д., Беляев Л.Б., Багненко С.Ф. Изменение ультраструктурных гепатоцитов при хроническом калькулезном холецистите и механической желтухе как прогностический фактор развития осложнений // Актуальные вопросы абдоминальной хирургии. Тезисы VII Всероссийского съезда хирургов.- Л., 1989.- 243 с.
8. Подымова С.Д. Болезни печени.- М.: Медицина, 1984.- 433 с.
9. Рывняк В.В., Гудумак В.С., Оня Е.С. Электронно-гистохимическая локализация коллагена в печени // Бюл. Эксперим. биологии и медицины.- 1996, ¦ 1- С. 98-100.
10. Хачатрян Р.Г., Альперович Б.И., Цхай В.Ф. Механическая желтуха.- Томск, 1994.- 303 с.
11. M. Motta. Biopathology of the liver: An ultrastructural approach / Ed. by P. Dordrecht etc. Kluwes acad. publ.- 1988.- 194 p.
12. Popper H., Schaffues F. Progress in liver discases // New York etc. Yrune Straffon.- 1982.- 682 p.
13. Rossi Z.,Milania A., Marra Z., Sicliano M. Changes in the parameters of hepatic function in biliary lithiasis // Quad. Sclavo. Diagn.- 1985.- V. 21.- ¦ 4.- Р. 430-435.
14. Swell Z., Gregori D.N. et al. Current
concepte of the pathogenesis of cholesterol gallstones // Med.
Clin.- 1978.- V. 58.- Р. 1447-1471.
The article deals with ultrastructural changes of
hepatocytes with cholelithiasis and their relation with clinical
and laboratory appearance of the disease. The role of hepatopetal
agents in hepatocyte injury and their significance for lithogenic
bile synthesis are emphasized.