УДК 547.962.9: 615.2:616-001.4
113093, Москва, ул. Б.Серпуховская 27, Институт
хирургии им.А.В.Вишневского, клинико-биохимическая лаборатория;
тел.: (095) 236-20-52, факс: +7(095) 237-08-14; E-mail:
timin@vishnev.msk.ru
Раннее выявление инфицирования в очаге воспаления играет важную роль в оптимальном выборе лечебных мероприятий, способствующих предотвращению развития инфекции. Особую актуальность приобретает диагностика инициации инфицирования в ранние сроки после операций на органах брюшной полости, т.к. клиническая картина внутрибрюшного гнойного осложнения замаскирована операционной травмой, проводимой антибактериальной и инфузионной терапией, что приводит к позднему выявлению осложнений. Поздняя диагностика внутрибрюшных гнойных осложнений после операций на органах брюшной полости является одним из факторов развития полиорганной недостаточности, повышающим послеоперационную летальность. При присоединении полиорганной недостаточности, ассоциированной с инфекцией, летальность достигает 90%-100% [1].
Одним из направлений исследований, позволяющих вплотную приблизиться к возможности прогнозирования динамики воспалительного процесса, является изучение физических, иммунологических и биохимических изменений, протекающих непосредственно в очаге воспаления. Однако сложность подобных исследований вызвана тем, что степень воспалительного процесса в очаге не всегда соответствует клиническим и лабораторным данным, используемым обычно в качестве контроля за течением послеоперационного периода. В процессе поиска критериев, позволяющих как можно раньше выявить начало инфицирования перитонеального экссудата, определение лизоцима является наиболее надежным методом [2].
Лизоцим (К.Ф. 3.2.1.17) - это бактериолитический фермент, который расщепляет гликозидную связь между первым атомом углерода N-ацетилмурамовой кислоты и четвертым атомом углерода N-ацетилглюкозамина в полисахаридах клеточной стенки бактерий, что приводит к гибели микроорганизмов [3]. Антибактериальный эффект лизоцима был открыт Флемингом в 1922 году, который и установил важное биологическое свойство фермента - бактериолитическое и бактериостатическое влияние на некоторые микроорганизмы [4]. Лизоцим синтезируется, в основном, в клетках, способных к фагоцитозу, - гранулоцитах и макрофагах. Локализуется фермент в нестимулированном нейтрофиле, в азурофильных и специфических гранулах. Нейтрофилы являются наиболее многочисленными и подвижными лейкоцитами. Выход нейтрофилов к очагу воспаления происходит в первые 2-4 часа после контаминации бактерий, задержка ведет к расширению зоны повреждения и способствует генерализации инфекции. Позже в очаге воспаления основную фагоцитирующую функцию выполняет макрофаг, который поглощает не только чужеродные тела, но и собственные деградирующие клетки организма, в том числе и разрушающиеся полиморфоядерные лейкоциты [5]. Развитие воспалительного процесса в брюшной полости сопровождается экссудацией и усиленной миграцией лейкоцитов в очаг воспаления.
В работе показана зависимость активности лизоцима от степени инфицированности раны [6], предложено определение активности лизоцима в крови для диагностики внутрибрюшных абсцессов [7] и для оценки степени риска развития гнойной инфекции при ранениях и тяжелой политравме [8]. Методы определения во всех случаях были основаны либо на измерении величины оптической плотности при добавлении фермента к бактериальной суспензии, либо на основе диффузии лизоцима в агар, либо на определении литической активности фермента с использованием хроматографии.
Известно, что лизоцим обладает определенной хитиназной
активностью (К.Ф.3.2.1.14), т. е. способностью гидролизовать
1,4-N-гликозидные связи между остатками ацетилгликозамина в хитине
(поли-N-ацетилглюкозамин). Впервые высказали предположение об
использовании определения хитиназной активности лизоцима в качестве
критерия, который как можно раньше показывал бы инициацию инфицирования,
U.Knapp и соавт., 1984. В этой работе проводилось определение
хитиназной активности лизоцима с использованием в качестве субстрата
хитиназура [2]. К сожалению, методика не была ими опубликована.
Приведенная здесь методика разработана в клинико-биохимической
лаборатории Института хирургии им. А.В Вишневского под руководством
проф. А.А.Карелина [9] и использовалась для определения хитиназной
активности лизоцима в перитонеальном экссудате.
Было обследовано 214 образцов дренажной жидкости, взятых от 88 больных после различных операций на органах брюшной полости на 3-й и 7-й день после операции. В зависимости от течения послеоперационого периода все больные были разделены на две группы:
1) больные, у которых послеоперационный период протекал без внутрибрюшных воспалительных осложнений - 67 (76%);
2) больные, у которых в послеоперационном периоде развились внутрибрюшные воспалительные осложнения - 21(24%). Верификацию наличия гнойного осложнения проводили на основании релапаротомий - 8(38%), пункций и дренирований под ультразвуковым (УЗИ) контролем - 6(29%), появления гнойного отделяемого по дренажу - 7(33%). Для анализа использовался экссудат без видимых признаков инфицирования (серозный). Клиническое проявление гнойных осложнений наблюдалось в среднем на 10¦1 день после оперативного вмешательства. У 4-х больных клиническая картина развилась на 4-6 день после операции. Клинические случаи с осложненным течением отбирали целенаправленно, поэтому представленный статистический материал не отражает истинной частоты послеоперационных осложнений.
Определение хитиназной активности лизоцима в перитонеальном экссудате проводили следующим образом.
В колбочку Эрленмейра объемом 20 мл помещают 1,8 мл 0,1 М раствора ацетатного буфера, рН 5,0; 1,0 мл коллоидного раствора хитиназура и 0,2 мл отделяемого из дренажей, подвергнутого кратковременному центрифугированию для отделения клеток и крупных частиц детрита. Конечная концентрация хитиназура в инкубационной среде составляет 1 мг/мл. Инкубацию проводят в течение 3х часов при температуре 370С при постоянном встряхивании. Реакцию останавливают быстрым отделением непрореагировавшего субстрата в ходе кратковременного центрифугирования (5 мин., 1000 g) и переносят 1,5 мл супернатанта в пробирку с 1,5 мл 0,1 М ацетатного буфера, рН 5,0. В качестве контроля используют пробы, в которых хитиназур отделяют сразу после смешивания компонентов при комнатной температуре. Об активности лизоцима судят по разности флюоресценции опытных и контрольных проб. Изменение флюоресценции проводят на флюориметре при 650 нм (длина волны возбуждающего света - 558 нм). Активность лизоцима выражают в условных единицах (1 усл. ед. равна 10-кратному количеству (мкг) освободившегося в раствор азура из хитиназура в расчете на 1 мл отделяемого по дренажам за час инкубации при 37оС).
Расчет количества лизоцима проводят по формуле:
Опыт (О) - Контроль (К) 10, где
Стандарт (Ст)
О - отклонение самописца флюориметра от нулевой точки в опытной пробе (в мм),
К - отклонение самописца флюориметра от нулевой точки в контрольной пробе (в мм),
Ст - отклонение самописца флюориметра от нулевой точки в стандартной пробе (в мм).
Таким образом, разработанный метод более предпочтителен
по сравнению с турбодиметрическим.
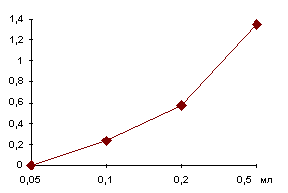
С целью доказательства, что при использовании в качестве
источника фермента отделяемого из дренажа имеется линейная зависимость
накопления флюоресцирующего продукта реакции в супернатанте от
количества внесенного фермента, мы провели следующий эксперимент:
в инкубационные сосудики добавляли по 0,05 мл; 0,1 мл;
0,2 мл; 0,5 мл супернатанта экссудата и 1,0 мл
раствора хитиназура. Общий объем инкубационной пробы доводили
до 3,0 мл 0,1 М ацетатного буфера, рН 5,0. Инкубацию
и определение концентрации азура в инкубационной среде после отделения
непрореагировавшего хитиназура проводили, как и в сыворотке крови.
Усл. ед. акт.

На представленном графике (рис. 1) четко прослеживается зависимость хитинолитической активности лизоцима от количества фермента.
Для выявления зависимости хитинолитической активности лизоцима от ряда факторов, таких как возраст, пол, объем и степень инфицированности оперативного вмешательства. С этой целью была проанализирована первая группа больных (без осложнений). Не было выявлено зависимости от пола, возраста, объема оперативного вмешательства.
Выявлена зависимость хитиназной активности лизоцима от степени инфицированности проведенного оперативного вмешательства. Так, у больных первой группы, перенесших условно-чистые операции, хитинолитическая активность лизоцима на третий день была 1,66 ¦ 0,02 усл. ед. акт. и снижалась к седьмому дню до 0,99 ¦ 0,03 усл. ед. акт.; у больных с загряз-ненными операциями - соответственно 1,22 ¦ 0,03 усл. ед. акт. и 0,81 ¦ 0,04 усл. ед. акт.; у больных, подвергшихся оперативному вмешательству по поводу первично инфицированных операций, - соответственно 0,65 ¦ 0,23 усл. ед. акт. и 0,23 ¦ 0,007 усл. ед. акт.
У больных второй группы после условно-чистых операций - хитиназная активность лизоцима составляла на третий день после операции 1,8¦0,4 усл. ед. акт., а на седьмой день - 3,47¦0,7 усл. ед. акт.; у больных, перенесших оперативное вмешательство по поводу первично инфицированных операций,- соответственно 2,33¦0,62 усл. ед. акт. и 2,4¦0,8 усл. ед. акт. Таким образом, хитинолитическая активность лизоцима зависит от степени инфицированности перенесенного оперативного вмешательства и выраженности защитных сил организма. Cледует отметить, что тенденция к повышению хитиназной активности у больных с внутрибрюшными гнойными осложнениями при сравнении с больными без осложнений сохраняется в зависимости от первоначальной степени инфицированности оперативного вмешательства и выраженная разница между показателями активности в двух группах позволяет утверждать, что присутствие инфекции является основополагающим фактором повышения хитиназной активности лизоцима.
Контролем служила перитонеальная жидкость, которую забирали непосредственно после вскрытия брюшной полости при отсутствии воспалительных явлений в брюшной полости (11 больных). Нормой хитиназной активности лизоцима в перитонеальной жидкости считаем 0,046¦0,008 усл. ед. акт.
Изестно, что лизоцим синтезируется, в основном, в клетках, способных к фагоцитозу,- гранулоцитах и макрофагах. В норме в перитонеальной жидкости присутствуют макрофаги, мезотелиальные клетки, небольшое количество лимфоцитов, эозинофилы, при воспалении появляется большое число полиморфноядерных клеток. Поэтому мы сопоставили данные хитиназной активности с типом цитограммы.
Оценка изменений цитограммы проводилась по классификации М.Ф.Камаева [10], согласно которой автор выделяет три типа цитограммы:
Для оценки полученных результатов с применением программно-алгоритмического обеспечения, нами была использована классификация типов цитограмм, предложенная О.С.Сергель (Институт хирургии им. А.В.Вишневского РАМН), которая предложила для оценки цитограммы экссудата и раневого процесса выделять следующие типы цитограмм: 1) некротический тип; 2) дегенеративно-воспалительный тип; 3) воспалительный тип; 4) воспалительный тип с аллергическим компонентом.
Некротическому типу цитограммы соответствовало 0,76¦0,17 усл. ед. акт.; гнойно-воспалительному типу - 1,0¦0,3 усл.ед.акт.; воспалительному типу - 1,7¦0,22 усл.ед.акт. и воспалительному типу с аллергическим компонентом - 1,7¦0,9 усл. ед. акт. Таким образом, прослеживается четкая зависимость хитиназной активности лизоцима от количества и активности нейтрофилов.
При сопоставлении данных, выявленных при изучении содержания летучих жирных кислот и токсических метаболитов (группы фенолов, крезолов и ароматических жирных кислот) методом газ-хроматографии и масс-спектрометрии [11], получено свидетельство того, что с хитиназной активностью лизоцима коррелировало содержание масляной кислоты (r = 0,916) и крезолов (r = 0,916).
Повышение уровня содержания летучих жирных кислот соответствовало развитию анаэробного процесса, а состав токсических метаболитов (группы фенолов и крезолов) соответствовал степени интоксикации и тяжести состояния больного.
Выявляется четкая тенденция к росту хитиназной активности лизоцима у больных с развившимися впоследствии гнойными внутрибрюшными осложнениями (уже на третий день после операции), что может служить диагностическим тестом инфицированности перитонеальной жидкости (табл.).
Таблица
|
| |||
| Норма | |||
| 3-й | |||
| 7-й | |||
| % изменения в динамике |
|
При значении хитиназной активности лизоцима на 7-й день после
операции ниже 1,0 ед. акт. у 87% больных послеоперационный
период протекал гладко, но при значении этого показателя выше
1,5 ед. акт. - у 70% развились внутрибрюшные гнойно-воспалительные
осложнения.
Благодаря специфичности метода, эффективность определения фермента в биологических жидкостях с диагностической целью значительно повышается, если данный фермент содержится только в одном или двух органах и тканях и отсутствует в других органах и тканях, включая кровь [12]. В случае появления такого фермента в крови или иных биологических жидкостях при наличии клинических признаков болезни с очевидностью решается вопрос об источнике его присхождения, а следовательно, еще повышается точность диагноза и прогноза течения заболевания. Поскольку лизоцим является широко распространенным ферментом в различных биологических жидкостях и тканях [3], то появление его в крови в раннем послеоперационном периоде будет иметь место и при нагноении послеоперационной раны, при пневмонии и постинъекционных абсцессах, что значительно снижает диагностическую ценность этого теста. В перитонеальной жидкости практически единственным источником лизоцима при инфицировании являются нейтрофилы и макрофаги. Именно поэтому, вследствие специфичности, надежность и топическая значимость диагностики инициации инфицирования перитонеального экссудата с помощью определения хитиназной активности лизоцима в перитонеальном экссудате значительно возрастает по сравнению с определением активности фермента в крови.
Представленные на рассмотрение результаты исследования могут явиться основой для разработки объективных клинико-лабораторных критериев ранней диагностики послеоперационных внутрибрюшных гнойно-воспалительных осложнений при использовании в качестве биологического материала перитонеального экссудата.
Следует отметить, что впервые была определена хитинолитическая активность лизоцима в перитонеальном экссудате с использованием в качестве субстрата фермента хитиназура и выявлена связь уровня хитинолитической активности лизоцима с выраженностью воспалительного процесса в брюшной полости, ведущего к внутрибрюшному гнойному осложнению. Исследователи G.M.Escott., D.J.Adams [13] сообщали об определении хитиназной активности лизоцима в сыворотке крови и лейкоцитах здоровых людей, применив в качестве субстрата фермента меченный по тритию коллоидный раствор хитина ([3H] хитин). Однако это более дорогостоящий изотопный метод определения хитиназной активности по сравнению с разработанной нами флуоресцентной детекцией продуктов гидролиза хитиназура.
Несомненно, использование субстрата хитиназура явится предпосылкой
для широкого внедрения хитинолитической реакции в клинику и окажет
серьезную помощь в диагностике инфекционных хирургических осложнений.
Использование в качестве исследуемой биологической жидкости визуально
не измененного перитонеального экссудата позволит на более ранних
стадиях применять малоинвазивные вмешательства, что позволит не
только своевременно диагностировать, но и предотвращать развитие
внутрибрюшных гнойных осложнений в послеоперационном периоде.
12. Карелин А.А., Короткина Р.Н. Некоторые современные аспекты диагностической энзимологии с помощью органоспецифических ферментов // Вестник АМН СССР.- 1984.- ¦ 8.- С. 89-94.
13. Escott G.M.,Adams D.J. Chitinase activity
in human serum and leukocytes // Infection and Immuniti.- 1995.-
V. 63, ¦ 12.- P. 4770-4773.
In the article there is an estimation of chitinase activity of lysozyme (CAL) as early indicators of suppuration in discharge from drainages. The first group of patients had no postoperative purulent complications (n = 67), the second one had intraabdominal suppurative inflammation (n = 21). The patients of the first group had the following values of the indicators of infection on the third day after operation /3 day a/o/: CAL 1,430,16 mcg of azure which got into the solution/ml of discharge from drains/hour, on the seventh day after operation (7 day a/o): CAL 0,810,20. Comparatively, the patients in the second group had the following values of the indicators of infection: 3 day a/o: CAL 2,23 0,52 (p=0,56); 7 day a/o: CAL 2,720,50 (p<0,01).
We propose that the new method of estimation of chitinase
activity of lysozyme with chitin azure as substrate helps to diagnose
suppurative complications in the early postoperative period after
operations of peritoneal cavity.