УДК 612.112:538.569
142292, г. Пущино Московской обл., Институт биофизики клетки РАН; тел.: (095) 9239668 доб. 315;
факс: (0967) 790509; E-mail: chemeris@venus.iteb.serpukhov.su
В последние годы очевиден прогресс в накоплении экспериментальных данных по влиянию электромагнитного излучения крайне высоких частот (ЭМИ КВЧ) на биологические объекты различного уровня организации - от субклеточных препаратов до целого организма [1-6]. Анализ большого количества работ позволил определить основные особенности действия КВЧ излучения на живые системы [7, 8]: а) низкая мощность излучения, при которой наблюдаются эффекты, вследствие чего принято говорить о нетепловых механизмах действия; б) наличие выраженных частотных зависимостей наблюдаемых эффектов - так называемых резонансных эффектов с эквивалентным фактором добротности до 500 и более; в) наличие лечебных эффектов излучения, что обеспечивает широкое применение методов КВЧ терапии в медицине [9].
Однако четкого представления о физико-химических механизмах действия КВЧ излучения на биологические системы на сегодняшний день нет, точно также нет ясности о природе сенсора крайне высоких частот в живых объектах. На этот счет существует только ряд гипотез: гипотеза когерентных возбуждений и взаимодействий [10], информационная гипотеза [11], гипотеза о солитонном механизме передачи энергии [12] и некоторые другие, связанные с эффективным поглощением энергии КВЧ излучения молекулами воды [13].
Анализ теоретических и экспериментальных данных по биологическим эффектам ЭМИ КВЧ указывает на необходимость решения ряда задач, что позволило бы систематизировать имеющиеся данные по степени их достоверности, а следовательно, и значимости для разработки дальнейших путей в исследовании механизмов действия ЭМИ КВЧ на живые системы. К таким задачам, по нашему мнению, относятся следующие: 1) проведение корректной дозиметрии излучения для конкретных условий эксперимента и излучающей системы, иначе трактовка получаемых результатов может быть неверной, поскольку артефакты при действии излучения на объект могут привести к обнаружению эффектов, вовсе не соответствующих специфическому действию ЭМИ; 2) выяснение роли структуры электромагнитного поля в плоскости облучаемого объекта, поскольку известные биотропные параметры ЭМИ КВЧ, такие как частота, плотность потока поглощаемой объектом энергии излучения, время воздействия, поляризация и модуляция излучения не исчерпывают возможные действующие на облучаемый объект факторы и поэтому не дают полной ясности в отношении механизмов действия КВЧ излучения. Поля ближней и дальней зон излучения принципиально различны, следовательно, могут вызывать различный биологический эффект.
Целью настоящей работы было сравнение действия ЭМИ
КВЧ в ближней (зоне индукции) и дальней (волновой) зонах на активность
клеток иммунной системы.
Работа выполнена с использованием перитонеальных вызванных нейтрофилов мышей SPF-категории (свободных от патогенных микроорганизмов) аутбредной линии NMRI. Мыши были получены из вивария барьерного типа лаборатории линейных животных филиала Института биоорганической химии им. акад. М.М. Шемякина и акад. Ю.А. Овчинникова. Средний вес экспериментальных животных составлял 25-30 г.
Использовали следующие реактивы и растворы: зимозан, люминол, форбол 12-миристат 13-ацетат (ФМА), кальциевый ионофор А23187, среду 199 и раствор Хенкса (Sigma, США); физиологический раствор для регистрации хемилюминесценции (в мМ): 138 NaCl, 6 KCl, 1 MgSO4, 1 Na2HPO4, 5 NaHCO3, 5,5 глюкозы, 1 CaCl2, 0,35 люминола, 10 HEPES/NaOH; pH = 7,4. Опсонизацию зимозана проводили аутологичной сывороткой.
Перитонеальные нейтрофилы выделяли аналогично методике,
описанной в работе [14], но с некоторыми модификациями. Выделенные
клетки ресуспендировали в среде 199 и хранили при +4оС
с постоянным перемешиванием, либо при +37оС непосредственно
в экспериментальных ячейках (20 мкл суспензии клеток на ячейку
с общим рабочим объемом 200 мкл). Нейтрофилы в суспензии составляли
более 85% всех клеток. Плотность нейтрофилов в ячейке составляла
около 1-2 млн клеток/мл.
Продукция активных форм кислорода (АФК) нейтрофилами
при активации ФМА или опсонизированным зимозаном оценивалась по
люминол-зависимой хемилюминесценции (ХЛ-Л), измеряемой по известной
методике [15]. ХЛ-Л регистрировали хемилюминометром ХЛ-111М, изготовленным
в лаборатории биофизики нервной клетки Института биофизики клетки
РАН. Конструкция хемилюминометра позволяла регистрировать ХЛ-Л
последовательно от 12 экспериментальных ячеек в условиях термостатирования
при 37оС. Время опроса всех 12 ячеек составляло 10
с при активации клеток ФМА и 1 минуту при активации опсонизированным
зимозаном. В течение первых 3-5 минут регистрировали спонтанную
ХЛ-Л клеток, затем в ячейки вносили активирующий агент и продолжали
запись уровня ХЛ-Л активированных нейтрофилов в течение необходимого
времени. Сигнал с хемилюминометра через аналого-цифровой преобразователь
поступал на персональный компьютер. В процессе эксперимента уровень
ХЛ-Л визуально оценивался в реальном масштабе времени по кривым,
выводимым на экран видеомонитора одновременно для всех 12 ячеек.
Последующий анализ данных проводили с помощью специализированных
программ, написанных на языке Turbo Pascal 7.0.
Для облучения нейтрофилов излучатель миллиметровых волн с апертурой 17,512,5 мм на основе желобкового волновода (далее желобковый излучатель), разработанный фирмой ПИРС (Особое конструкторское бюро информационных технологий, Россия), соединяли с высокочастотным генератором сигналов Г4-141. Генератор позволял устанавливать частоту излучения в диапазоне 37,50-53,57 ГГц. Стабильность частоты генератора составляла 0,05%, паразитная девиация частоты выходного сигнала в режиме непрерывной генерации была не более 6 МГц. Частоту выходного сигнала контролировали волномером Ч2-25. Максимальная измеренная с помощью термисторной головки М5-49 выходная мощность генератора составляла 58 мВт.
Облучение нейтрофилов проводили со стороны дна пластиковых ячеек. Толщина дна ячеек составляла 0,2-0,3 мм. При помещении в ячейку клетки нейтрофилы прикреплялись к ее дну и через несколько минут представляли собой монослой толщиной менее 0,1 мм, общая высота столба раствора в ячейке составляла 2 мм. Облучали одновременно шесть ячеек при комнатной температуре 19-22оС. Исследование действия излучения проводили на двух моделях: 1) облучали интактные клетки в течение 40 минут, затем, после прекращения облучения, респираторный взрыв нейтрофилов инициировали опсонизированным зимозаном (25 мкг/мл) и сравнивали продукцию АФК в облученных и контрольных образцах; 2) нейтрофилы облучали в течение 20 минут в присутствии кальциевого ионофора А23187 в концентрациях 7,5-10 мкМ. Контрольные клетки также в течение 20 минут обрабатывали кальциевым ионофором, но не облучали. Затем клетки активировали ФМА (1 мкМ) и сравнивали продукцию АФК опытных и контрольных нейтрофилов.
Пространственное распределение и оценку плотности
потока энергии (ППЭ) в дальней зоне желобкового излучателя на
расстояниях 200-1000 мм от его торца определяли с помощью
панорамного измерителя Р2-68. В качестве приемной антенны в этих
экспериментах использовали пи-рамидальную рупорную антенну с апертурой
32 32 мм. Расчет плотности потока поглощен-ной
энергии (ПППЭ) на расстоянии х от излучающего торца желобкового
излучателя осущест-вляли по формуле P = Po / (1 + x / a)2,
где а = 98 мм, Po = 3,76 мВт/см2
при максимальной мощности на выходе генератора около 58 мВт. Параметры
a и Po были определены экспериментально
с помощью измерений ППЭ и удельной поглощенной мощности (УПМ)
[14]. Принимая во внимание глубину скин-слоя для ЭМИ КВЧ, составляющего
около 0,78-0,23 мм в диапазоне частот 30-300 ГГц [16],
по оценке УПМ в слое раствора толщиной около 0,1-0,2 мм получали
величину ПППЭ, соответствующую поглощению излучения слоем раствора
с клетками. В ближней зоне желобкового излучателя на расстояниях
10-100 мм от его торца УПМ оценивали с помощью микротермопары
по скорости роста температуры в экспериментальной ячейке, заполненной
физиологическим раствором. ПППЭ в ближней зоне рассчитывали пропорционально
УПМ с учетом площади дна ячейки и массы раствора.
Суммарную продукцию АФК нейтрофилами оценивали пропорционально площади под кривой зависимости интенсивности ХЛ-Л от времени. За нулевой уровень принимали среднюю интенсивность спонтанной ХЛ-Л, за начало отсчета - момент подачи активирующего агента и считали площадь под кривой за 5-15 минут. Для дальнейшего анализа усредняли полученные значения суммарной продукции АФК для контрольных и облученных нейтрофилов, а отличие контроля от опыта оценивали как разность усредненных значений в контроле и в опыте, нормированную к контролю и выраженную в процентах. В случае, например, превышения суммарной продукции АФК в контроле над опытом получали положительную величину в процентах, отражающую степень ингибирования ХЛ-Л нейтрофилов под действием КВЧ излучения.
Статистический анализ данных проводили по t-критерию
Стьюдента. Достоверность результатов оценивалась по границам доверительного
интервала с вероятностью p > 0,95.
Чаще всего облучение биологических объектов в диапазоне КВЧ проводится в ближней зоне излучателей на расстояниях R < 2D2 / от излучающего торца антенн. Однако неоднородность ЭМП в ближней зоне может быть одной из причин артефактов. В плоскости объекта может существовать многомодовая интерференционная картина распределения УПМ, которая и определяет неравномерность поглощенной в объекте энергии ЭМИ КВЧ [17].
Ранее нами была проведена корректная дозиметрия излучения при использовании желобкового излучателя [14]. Для выбора оптимальной системы облучения мы провели тестирование трех типов антенн: рупорной, диэлектрической и разработанного нами желобкового излучателя. Согласование антенн с питающим трактом и согласование излучения с объектом оценивалось по величине коэффициента стоячей волны (КСВ) в подводящем тракте при использовании в качестве нагрузок сплошного металлического экрана (режим короткого замыкания), свободного пространства (холостой ход антенн) и биологического объекта (держатель с заполненными физиологическим раствором ячейками). Удовлетворительным можно считать КСВ < 1,5, при котором потери на отражение составляют около 4% мощности. КСВ для рупорной и диэлектрической антенн в режиме короткого замыкания оказывается неприемлемо большим: до 10 для рупорной антенны и до 3,8 для диэлектрической. КСВ для желобкового излучателя не превышает в этом случае 2,4, и характер его изменения от частоты существенно более плавный, чем для двух других антенн. При холостом ходе антенн КСВ для желобкового излучателя и рупорной антенны меняется в пределах от 1,01 до 1,18 достаточно плавно. КСВ диэлектрической антенны для этого случая оказывается большим и меняется в пределах от 1,3 до 1,68. Если нагрузкой служит биологический объект, то в зависимости от его геометрических параметров и расстояния от излучающего торца антенны характер изменения КСВ от частоты может быть промежуточным между рассмотренными предельными случаями. Причем расположению объекта в ближней зоне излучателя будет более соответствовать режим короткого замыкания.
Термографическим методом мы показали, что желобковый излучатель обеспечивает (в отличие от рупорной и диэлектрической антенн) распределение УПМ в плоскости фантома без локальных пятен перегрева во всем диапазоне используемых частот 37,5-53,5 ГГц. Было обнаружено единственное пятно разогрева, имеющее эллиптическую форму, площадь которого возрастает прямо пропорционально квадрату расстояния от торца излучателя. Оценка площади пятна разогрева в дальней зоне антенны выполнена с помощью панорамных измерений по ослаблению уровня мощности на 3 дБ при смещении приемника излучения перпендикулярно оси излучателя в направлении Е- и Н-векторов поля.
Таким образом, показано, что желобковый излучатель обладает хорошей направленностью, обеспечивает широкополосное согласование излучения с облучаемым объектом во всем используемом диапазоне частот (37,5-53,5 ГГц) и однородность распределения УПМ в плоскости объекта как в ближней, так и в дальней зонах антенны, что, как мы полагаем, позволяет использовать эту излучающую систему для безартефактного облучения биологических объектов в ближней и дальней зонах излучателя. Исходя из размера необходимой зоны равномерного облучения исследуемого биологического объекта и оптимальной ПППЭ, плоскость объекта располагали на фиксированном расстоянии от торца излучателя: 65 мм в ближней зоне и 400 мм в дальней зоне антенны. При этом ПППЭ в ближней зоне была равна 240 мкВт/см2, а в дальней зоне - около 100 мкВт/см2.
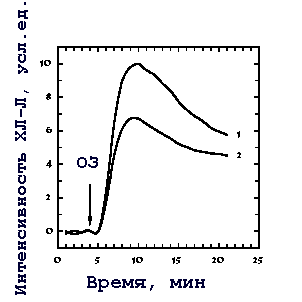
Мы исследовали действие непрерывного ЭМИ КВЧ на продукцию АФК перитонеальными нейтрофилами мыши, облучаемыми в ближней и дальней зонах желобкового излучателя. Оригинальные записи уровня ХЛ-Л клеток, активированных опсонизированным зимозаном, представлены на рис. 1. Облучение нейтрофилов как в ближней, так и в дальней зонах вызывало ингибирование продукции АФК клетками. Причем было обнаружено, что эффект излучения имеет различный характер в ближней и дальней зонах (рис. 2). В ближней зоне обнаружено резонансное ингибирование ХЛ-Л с максимумом около 25% на частоте 41,95 ГГц. В дальней зоне этот эффект практически не зависел от частоты излучения и в среднем составлял 12%. В то же время зависимости величины эффекта от ПППЭ в дальней и ближней зонах качественно аналогичны: полумаксимальное ингибирование наблюдается при значениях ПППЭ около 1 мкВт/см2 [14].

Рис. 1. Оригинальные записи уровня люминол-зависимой хемилюминесценции нейтрофилов, активированных опсонизированным зимозаном 25 мкг/мл (ОЗ). 1 - контрольные клетки, 2 - клетки, облученные в дальней зоне желобкового излучателя (непрерывная генерация, fн = 41,95 ГГц, ПППЭ - 100 мкВт/см2, время облучения - 40 мин.)
Поскольку условия эксперимента при облучении интактных нейтрофилов в ближней и дальней зонах были аналогичны, мы полагаем, что различия в частотных характеристиках эффектов обусловлены различной структурой и характером ЭМИ в ближней и дальней зонах антенны. Необходимы дальнейшие детальные и достаточно трудоемкие исследования как структуры электромагнитного поля ближней зоны, так и особенностей его взаимодействия с облучаемым биологическим объектом. Поэтому методически более корректно облучать биологический объект в дальней зоне излучателей, где условия облучения определены более четко: 1) фронт волны сформирован, и имеется поперечная плоская волна; 2) векторы Е и Н ортогональны между собой и ортогональны направлению распространения волны (в отличие от ближней зоны, в дальней зоне имеется только бегущая волна); 3) компоненты векторов Е и Н в дальней зоне убывают обратно пропорционально первой степени расстояния от антенны и их соотношение постоянно, в то время как в ближней зоне преобладает энергия электрического поля; 4) в дальней зоне согласование излучения с нагрузкой в основном определяется параметрами самой нагрузки, в отличие от ближней зоны, где сильно сказывается влияние антенны.
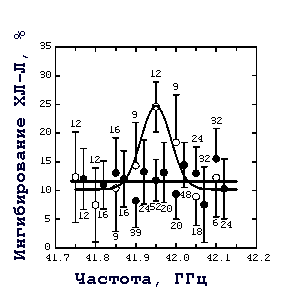
Рис. 2. Зависимость степени ингибирования люминол-зависимой хемилюминесценции нейтрофилов, активированных опсонизированным зимозаном, от частоты КВЧ излучения. Время воздействия излучения на интактные нейтрофилы - 40 мин. - величина эффекта в ближней зоне желобкового излучателя (на расстоянии 65 мм от его торца, ПППЭ - 240 мкВт/см2); - величина эффекта в дальней зоне (на расстоянии 400 мм от торца излучателя, ПППЭ - 150 мкВт/см2). Прямой линией показана средняя величина эффекта в дальней зоне. Каждая точка на графике представляет среднее значение указанного числа независимых экспериментов; доверительный интервал (p > 0,95), рассчитан по критерию Стьюдента (то же - для рис. 4)
Анализ действия ЭМИ КВЧ на многокомпонентную реакцию - активацию нейтрофилов опсонизированным зимозаном [18], включающую в себя взаимодействие лиганда с рецептором, активацию внутриклеточных сигнальных систем и НАДФH-оксидазы, довольно сложен. Поэтому для дальнейших исследований действия излучения на нейтрофилы было необходимо упростить модель активации клетки. Трансдукция рецепторного сигнала при активации нейтрофила во многих случаях осуществляется через систему: рецептор ГТФ-связывающий белок активация фосфолипазы С гидролиз фосфатидилинозитол(4,5)дисфосфата до инозитол(1,4,5)трисфосфата и диацилглицерола мобилизация Ca2+ и активация протеинкиназы С (ПКС) фосфорилирование НАДФН-оксидазы [19]. Мобилизация Ca2+ из внутриклеточных депо и активация протеинкиназ, в частности ПКС, являются ключевыми моментами в активации НАДФН-оксидазы. Применение кальциевых ионофоров позволяет исключить начальные стадии трансдукции рецепторного сигнала. Известно, что при одновременном действии на клетки кальциевого ионофора А23187, повышающего уровень цитоплазматического свободного кальция ([Ca2+]i), и форболового эфира, активирующего ПКС, развивается усиленный ответ клетки [20], значительно превышающий ответ при действии каждого из этих агентов в отдельности (рис. 3). Модель синергического действия кальциевого ионофора А23187 и ФМА [21] далее использовалась нами для исследования эффектов ЭМИ КВЧ на нейтрофилы.
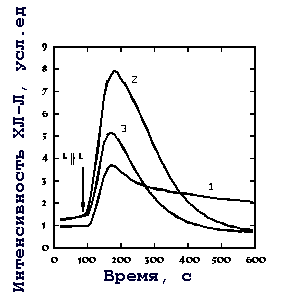
Рис. 3. Оригинальные записи уровня люминол-зависимой хемилюминесценции нейтрофилов, активированных ФМА (1 мкМ). 1 - интенсивность ХЛ-Л интактных клеток, 2 и 3 - ХЛ-Л клеток, предварительно обработанных А23187 (7,5 мкМ). 1, 2 - необлученные клетки; 3 - облученные клетки (непрерывная генерация, fн = 41,95 ГГц, ПППЭ - 100 мкВт/см2, время облучения - 20 мин.)
Ранее нами было показано, что величина эффекта КВЧ излучения на синергическую реакцию кальциевого ионофора и форболового эфира в нейтрофилах нелинейно зависит от концентрации А23187. В области концентраций А23187 от 50 нМ до 2 мкМ эффект излучения отсутствовал, а обнаруживался только при высоких концентрациях А23187 (выше 3 мкМ), на фоне которых в клетке создается повышенный уровень [Ca2+]i, поддерживаемый в течение времени облучения. В этих условиях ионофор обеспечивает мобилизацию Ca2+ на ранних временах и ионофорный перенос в течение всего времени действия [22]. Мы выбрали узкий диапазон концентраций А23187 от 7,5 до 10 мкМ, где наблюдалось стабильное ингибирование синергической реакции под действием излучения [21].
Исследование действия непрерывного ЭМИ КВЧ в узком частотном диапазоне (41,75-42,15 ГГц) на реакцию синергизма кальциевого ионофора А23187 и ФМА в нейтрофилах показало высокую селективность систем связанных биохимических реакций, участвующих в активации респираторного взрыва, к несущей частоте излучения (рис. 4). При несущей частоте излучения 41,95 ГГц обнаружено максимальное ингибирование синергической реакции - около 25%, достоверно отличающееся от эффекта ЭМИ КВЧ для других несущих частот. ПППЭ в этой серии экспериментов была около 50 мкВт/см2. Величина эффекта слабо зависела от ПППЭ и при ПППЭ от 20 до 150 мкВт/см2 в среднем составляла около 24%.
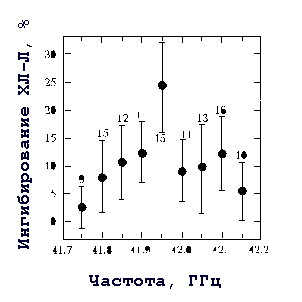
Рис. 4. Резонансное ингибирование синергической реакции кальциевого ионофора А23187 и форболового эфира ФМА в нейтрофилах, оцениваемое по уровню ХЛ-Л, в результате действия непрерывного КВЧ излучения с ПППЭ - 50 мкВт/см2 в дальней зоне желобкового излучателя
Таким образом, мы обнаружили резонансное ингибирование продукции АФК нейтрофилов в синергической реакции кальциевого ионофора А23187 и форболового эфира ФМА под действием низкоинтенсивного ЭМИ КВЧ в дальней зоне желобкового излучателя. Частотная зависимость данного эффекта принципиально отличается от частотной зависимости эффекта ЭМИ КВЧ на активацию нейтрофилов опсонизированным зимозаном, когда клетки также облучали в дальней зоне излучателя. С другой стороны, частота 41,95 ГГц одинакова как для резонансного эффекта КВЧ излучения в дальней зоне на синергическую реакцию А23187 и ФМА, так и для резонансного эффекта излучения в ближней зоне при активации клеток опсонизированным зимозаном. Отсутствие резонансного эффекта в дальней зоне антенны при активации клеток рецептор-зависимым путем с помощью опсонизированного зимозана и наличие резонансного эффекта, опять же, в дальней зоне при активации нейтрофилов рецептор-независимым путем с помощью форболового эфира может быть объяснено следующим образом. На основании полученных данных можно предположить, что в клетке имеются мишени для действия низкоинтенсивного ЭМИ КВЧ, причем есть система внутриклеточной сигнализации, включенная в активацию респираторного взрыва нейтрофилов, высокочувствительная к частоте 41,95 ГГц (рис. 2 и 4). Очевидно, что эта система является кальций-зависимой, поскольку эффект зависит от концентрации кальциевого ионофора и проявляется только при высокой концентрации ионофора, когда уровень [Ca2+]i существенно повышен и поддерживается продолжительное время [22] в отличие от рецепторной активации, когда возникает кратковременное увеличение [Ca2+]i. Однако связанные системы биохимических реакций, включенные в активацию респираторного взрыва, могут быть чувствительны и к другим частотам излучения (не только к 41,95 ГГц). Более того, отклик различных, чувствительных к действию ЭМИ КВЧ биохимических систем может различаться как по величине, так и по направлению. Поэтому при облучении невозмущенной системы, каковой являются интактные клетки, суммарный по всем включенным системам биохимических реакций эффект излучения может отсутствовать, либо, как, например, в случае облучения интактных нейтрофилов в дальней зоне желобкового излучателя (рис. 2), может быть мал и не зависеть от частоты излучения. В дальней зоне антенны структура поля однородна и на объект действует поперечная плоская волна. При действии излучения в дальней зоне антенны, но на возмущенную систему (клетки с повышенной активацией [Ca2+]i), отклик системы оказывается резонансным за счет усиления активности биохимических реакций, чувствительных к частоте 41,95 ГГц. Почему же в ближней зоне при действии ЭМИ КВЧ на интактные клетки (невозмущенную систему) обнаруживается резонансный эффект? Неоднородная структура поля и стоячие волны ближней зоны могут оказывать на объект дополнительное возмущающее действие, и начинает проявляться резонансный отклик высокочувствительных к частоте 41,95 ГГц биохимических систем.
Безусловно, определение особенностей структуры электромагнитного поля ближней зоны, которые приводят к дополнительному воздействию на биологический объект, требует дальнейших детальных экспериментальных и теоретических исследований. Проведение работ в этом направлении, возможно, даст ключ к объяснению специфических механизмов действия ЭМИ КВЧ на живые системы, что пока остается загадкой.
Основываясь на полученных нами экспериментальных данных, можно предположить, что ЭМИ КВЧ влияет на кальций-зависимые системы внутриклеточной сигнализации. Эффект излучения может быть связан с изменением [Ca2+]i или сродства белков, включая протеинкиназу С, к ионам кальция.
Авторы благодарят Б.Ф. Санталова за техническое обеспечение
экспериментов и ряд ценных советов. Работа выполнена при финансовой
поддержке Richard J. Fox Foundation (USA) и Российского Фонда
Фундаментальных Исследований (код проекта 96-04-49515).
1. Grundler W., Kaiser F. Experimental evidence for coherent excitations correlated with cell growth // Nanobiology.-1992.- Vol.1.- P.163-176.
2. Belyaev I.Ya., Alipov Ye.D., Polunin V.A., Shcheglov V.S. Evidence for dependence of resonant frequency of millimeter wave interaction with Escherichia coli K12 cells on haploid genome length // Electro- and Magnetobiology.- 1993.- Vol.12.- No.1.- P. 39-49.
3. Катаев А.А., Александров А.А., Тихонова Л.И., Берестовский Г.Н. Частотозависимое влияние миллиметровых электромагнитных волн на ионные токи водоросли Nitellopsis. Нетепловые эффекты // Биофизика.- 1993.- Т. 38.- Вып. 3.- C. 446-462.
4. Гапеев А.Б., Чемерис Н.К., Фесенко Е.Е., Храмов Р.Н. Резонансные эффекты модулированного КВЧ поля низкой интенсивности. Изменение двигательной активности одноклеточных простейших Paramecium caudatum // Биофизика.- 1994.- Т. 39.- Вып. 1.- C. 74-82.
5. Geletyuk V.I., Kazachenko V.N., Chemeris N.K., Fesenko E.E. Dual effect of microwaves on single Ca2+-activated K+ channels in cultured kidney cells Vero // FEBS Lett.- 1995.- Vol. 359.- P. 85-88.
6. Fesenko E.E., Geletyuk V.I., Kazachenko V.N., Chemeris N.K. Preliminary microwave irradiation of water solutions changes their channel-modifying activity // FEBS Lett.- 1995.- Vol. 366.- P. 49-52.
7. Девятков Н.Д., Бецкий О.В. Особенности взаимодействия миллиметрового излучения низкой интенсивности с биологическими объектами // В сб. статей под ред. акад. Н.Д.Девяткова Применение миллиметрового излучения низкой интенсивности в биологии и медицине.- М.: ИРЭ АН СССР, 1985.- C. 6-20.
8. Голант М.Б., Брюхова А.К., Реброва Т.Б. Некоторые закономерности действия электромагнитных излучений миллиметрового диапазона на микроорганизмы // В сб. статей под ред. акад. Н.Д. Девяткова Применение миллиметрового излучения низкой интенсивности в биологии и медицине.- М.: ИРЭ АН СССР, 1985.- C. 157-161.
9. Андреев Е.А., Белый М.У., Ситько С.П. Реакция организма человека на электромагнитное излучение миллиметрового диапазона // Вестник АН СССР.- 1985.- ¦ 1.- C. 24-32.
10. Frohlich H. Theoretical physics and biology // In: Frohlich H.(ed.) Biological coherence and response to external stimuli.- Springer, Berlin Heidelberg New York.- 1988.- P. 1-24.
11. Девятков Н.Д., Голант М.Б., Бецкий О.В. Миллиметровые волны и их роль в процессах жизнедеятельности.- М.: Радио и связь, 1991.- 168 с.
12. Давыдов А.С. Биология и квантовая механика.- Киев: Наукова думка, 1979.- 296 с.
13. Новскова Т.А., Гайдук В.И. Связь спектров поглощения с вращательным движением молекул жидкой и связанной воды // Биофизика.- 1996.- Т. 41.- Вып. 3.- C. 565-582.
14. Гапеев А.Б., Сафронова В.Г., Чемерис Н.К., Фесенко Е.Е. Модификация активности перитонеальных нейтрофилов мыши при воздействии миллиметровых волн в ближней и дальней зонах излучателя // Биофизика.- 1996.- Т. 41.- Вып. 1.- C. 205-219.
15. Allen R.C., Loose L.D. Phagocytic activation of a luminol-dependent chemiluminescence in rabbit alveolar and peritoneal macrophages // Biochem. Biophys. Res. Comm.- 1976.- Vol. 69.- No.1.- P. 245-252.
16. Furia L., Hill D.W., Gandhy O.P. Effect of millimeter-wave irradiation on growth of Saccharamyces cerevisiae // IEEE Trans. Biomed. Eng.- 1986.- Vol. BME-33.- No. 11.- P. 993-999.
17. Khizhnyak E.P., Ziskin M.C. Heating patterns in biological tissue phantoms caused by millimeter wave electromagnetic irradiation // IEEE Trans. Biomed. Eng.- 1994.- Vol. 41.- No. 9.- P. 865-873.
18. Downey G.P., Fukushima T., Fialkow L., Waddell T.K. Intracellular signaling in neutrophil priming and activation // Seminars in Cell Biology.- 1995.- Vol. 6.- P. 345-356.
19. Badwey J.A., Karnovsky M.L. Production of superoxide by phagocytic leukocytes: A paradigm for stimulus-response phenomenon // Current Topics in Cellular Regulation.- 1986.- Vol. 28.- P. 183-208.
20. Nishizuka Y. Intracellular signalling by hydrolysis of phospholipids and activation of protein kinase C // Science.- 1992.- Vol. 258.- P. 607-614.
21. Сафронова В.Г., Гапеев А.Б., Аловская А.А., Габдулхакова А.Г., Чемерис Н.К., Фесенко Е.Е. Миллиметровые волны ингибируют синергический эффект кальциевого ионофора А23187 и форболового эфира в активации респираторного взрыва нейтрофилов // Биофизика.- 1996.
22. Safronova V.G., Alovskaya A.A., Gabdulhakova
A.G., Dedkova E.N., Zinchenko V.P., Chemeris N.K. Priming
mechanism of calcium ionophores in activation of neutrophil respiratory
burst // Biophys. J.- 1997.- Vol. 72.- No. 2 (part
2 of 2).- P. A296.
Using free of artefacts channel radiator, frequency dependencies of the effects of extremely high frequency electromagnetic radiation (EHF EMR) on the mouse peritoneal neutrophil activity were investigated, when the cells were irradiated in the near and far field zones of the radiator. Production of reactive oxygen species (ROS) during the neutrophil respiratory burst was estimated by the luminol-dependent chemiluminescence technique. Under irradiation of the intact neutrophils in the near field zone of the radiator and further activation of the respiratory burst by opsonized zymosan, the resonance inhibition of the ROS production was found, with the maximum effect being at the radiation frequency of 41.95 GHz. Similarly, the resonance inhibition of the ROS production was observed at the same radiation frequency, when the cells were irradiated in the far field zone in the presence of calcium ionophore A23187 and then the neutrophil respiratory burst was activated by phorbol ester PMA. However, the frequency dependence of the effect was not observed, when the intact cells were irradiated in the far field zone and the respiratory burst was activated by opsonized zymosan. The obtained results show essential difference in the EHF EMF interaction with the biological system in the near and far field zones of the radiator. The EHF EMR influences efficiently the perturbed biological system, but in the near field zone the nonuniform electromagnetic field structure and standing waves can perturb the cells, and the EHF EMR causes the resonance effect corresponded to the most selective frequency of biochemical reactions participated in the cell activity investigated.