УДК 616.89-008.441.33
Наркомания как медицинская и социальная проблема имеет в настоящий момент чрезвычайно важное значение. Не секрет, что с увеличением демократических свобод и снижением инфляции в нашей стране доступность наркотических средств определяет Lпандемическое¦ распространение наркоманий, особенно среди молодежи. По некоторым данным, до 85% подростков в той или иной степени употребляют наркотические средства. Среди наркоманий потребление опиатов - героина, морфина, Lметадона¦, опия и других продуктов, содержащих алкалоиды мака,- занимает первое место как у нас в стране, так и в мире.
Хорошо известно, что длительное введение в организм опиатов вызывает формирование физической зависимости, т. е. при прекращении приема наркотика возникает синдром отмены. Именно это, а не психологическая зависимость (патологическое влечение) лежит в основе употребления опиатов у больных со средним или длительным Lстажем¦ наркомании. Считается, что около 80% больных опийной наркоманией, не испытывая уже таких острых приятных ощущений вследствие развития толерантности, желают прекратить прием наркотика. Однако все их попытки в большинстве случаев заканчиваются неудачей в связи с непереносимостью резко выраженных болевых и вегетативных компонентов абстинентного синдрома. В настоящий момент эффективное купирование абстинентного синдрома осуществляют в США и Европейских странах путем приема Lлегкого¦ опиата метадона. LМетадоновые программы¦ в этих странах стали возможны в связи с тем, что эффективного ненаркотического средства для лечения опийной абстиненции до настоящего времени не существует. В России использование метадона, а также применяемое ранее литическое купирование абстиненции (введение постепенно снижающихся доз морфина), равно как и применение любых наркотических средств для лечения наркомании запрещено. В связи с этим огромное количество больных наркоманией, желающих прекратить прием наркотика, не обращаются за врачебной помощью, так как знают о предстоящей им в этом случае мучительной Lломке¦. Это является одним из факторов, лежащих в основе того, что число наркоманов в России не уменьшается, а постоянно растет. Кроме того, неверие в эффективность лечения и необращение к врачам затрудняет учет распространения наркоманией, что в совокупности резко усиливает социальные последствия этого заболевания.
В основе формирования синдрома отмены лежат изменения многих нейрохимических систем, в том числе и пептидных систем мозга и периферии [3]. Наряду с эндогенными опиоидами [4], в механизмах формирования зависимости и синдрома отмены морфина и других опиатов, принимают участие множество неопиоидных пептидов, а также более крупных, полипептидных молекул [1, 6, 7, а также Little, Kuhn, 1995; Spanagel et al., 1996]. Известно, что распад полипептидных молекул, осуществляющийся ферментами пептидазами, приводит, с одной стороны, к инактивации активных полипептидов, а с другой стороны - к расщеплению инертных предшественников с образованием биологически активных пептидных форм. В связи с этим процессы деградации полипептидов могут играть определенную роль в формировании синдрома отмены. Было обнаружено, что введение в боковые желудочки мозга ингибитора протеолитических ферментов апротинина приводило к подавлению синдрома отмены у морфин-зависимых крыс. Авторы сделали предположение, что апротинин, блокируя действие энкефалиназ, увеличивает уровень эндогенных энкефалинов, что и вызывает уменьшение выраженности синдрома отмены (Pinsky et al., 1982). С другой стороны, нами было показано, что внутрибрюшинное введение крысам Сa++-зависимых эндопептидаз антипаина и люпептина, существенно снижает выраженность синдрома отмены у морфин-зависимых крыс (Lyupina et al., 1996). Практическая непроницаемость гематоэнцефалического барьера для ингибиторов протеолиза заставила нас думать о периферическом действии указанных соединений. В связи с этим для дальнейшего исследования был выбран ингибитор протеолитических ферментов - апротинин, разрешенный Министерством Здравоохранения РФ для клинического применения по другим показаниям.
Целью данной работы являлось исследование влияния
периферического введения апротинина на синдром отмены у морфин-зависимых
крыс и у больных опийной наркоманией в условиях наркологического
стационара. Поскольку
существовало мнение, что апротинин оказывает фармакологический
эффект за счет угнетения ферментов, подавляющих катаболизм энкефалинов,
отдельной задачей было сравнение в экспериментах на крысах действия
на синдром отмены морфина апротинина с селективным ингибитором
энкефалиназ (N-Carboxymethyl-Phe-Leu).
Кроме того, в последнее время клиническое применение препаратов,
содержащих апротинин, постепенно уменьшается в связи с более мощным
терапевтическим эффектом аналогов соматостатина, действующих за
счет угнетения выброса в кровь ряда пептидных гормонов и ферментов.
Поэтому мы провели сравнение действия апротинина с наиболее популярным
в настоящее время аналогом соматостанина - сандостатином, проявляющим
ингибирование активности большинства периферических полипептидных
гормонов.
Эксперименты проведены на 90 крысах линии Wistar, самцах, весом в начале экспериментов - 180-200 г. Крыс содержали в клетках по 8-10 животных в условиях искусственного освещения (12 часов в сутки), постоянного доступа к стандартному комбинированному корму и воде.
У животных формировали физическую зависимость от морфина по классической методике [2, 5, 8]. Крысам вводили гидрохлорид морфина в течение 8 дней в дозах, возраставших от 10 до 60 мг/кг, 2 раза в день с интервалом 12 часов. 10-ти контрольным крысам вместо морфина вводили дважды в день равный объем раствора хлорида натрия. Через 6 часов после последней инъекции животным проводили Lпровокацию¦ абстинентного синдрома инъекцией антагониста опиоидных рецепторов - налоксона - в дозе 1 мг/кг. Через 10 минут после этого крыс индивидуально помещали в автоматизированную установку Lоткрытое поле¦ на 3 минуты для регистрации появления специфических абстинентных реакций: отряхиваний, нарушения дыхания, птоза, корчей, скрежета зубами и диареи.
В экспериментах принимало участие 7 групп животных по 10 крыс в каждой группе. За 1 час перед помещением в Lоткрытое поле¦ группе Lздоровых¦ крыс, не получавших морфин, так же, как и контрольным Lморфинизированным¦ крысам внутрибрюшинно вводили 1 мл/кг изотонического раствора хлорида натрия. Крысам третьей, четвертой и пятой группы внутрибрюшинно вводили 0,02; 0,2 или 2 мг/кг апроти-нина (1 мг = 250 трипсин-ингибиторных единиц). Крысам шестой и седьмой групп вводили 0,01 и 0,1 мг/кг аналога соматостатина с пролонгированным действием (Сандостатин фирмы LСандос¦, Швейцария). Животным восьмой и девятой групп внутрибрюшинно вводили ингибитор энкефалиназ N - Carboxymethyl - Phe - Leu (Sigma, США) в дозах 0,5 и 2,0 мг/кг.
Подсчитывали суммарный показатель абстиненции (сумму имеющихся признаков) и частоту встречаемости признаков индивидуально у каждой крысы. Различия считали достоверными при p<0,05, вычисляя t-критерий для непарных случаев, используя пакет программ LMicrostat¦.
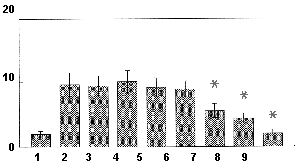
В результате экспериментов было установлено, что у животных контрольной группы наблюдались признаки синдрома отмены морфина разной степени выраженности. Средний суммарный показатель, характеризующий все исследуемые общеповеденческие и специфические реакции животных, в контрольной группе был равен 9,7+1,8. LЗдоровые¦ крысы, которым вместо морфина вводили изотонический раствор хлорида натрия, также имели определенное значение суммарного показателя (2,0+0,45) за счет таких неспецифических признаков, как встряхивания лапами или головой, редко - птоза и скрежета зубами). Введение апротинина в дозе 0,02 мг/кг за 1 час до тестирования приводило к тому, что проявление абстиненции у этих животных было выражено меньше, чем у контрольных. Средний суммарный показатель был равен 5,67+1,12, что на 42% меньше, чем в контроле (p<0,05) (рис. 1). Уменьшение суммарного показателя синдрома отмены происходило, в основном, за счет таких показателей, как отряхивания Lмокрой собаки¦, дергание головой и лапами, диспноэ, птоз и скрежет зубами. Апротинин в данной дозе не снижал такие проявления абстиненции, как диарея и корчи (табл. 1). Препарат повышал уровень вертикальной двигательной активности (число стоек), сниженный у зависимых животных. Увеличение дозы апротинина до 0,2 и 2 мг/кг приводило к еще большему уменьшению выраженности синдрома отмены: суммарный показатель был равен 4,44+0,83 и 2,11+0,54 (рис. 1). Также дозозависимо уменьшались и отдельные признаки синдрома отмены. Средний суммарный показатель у группы крыс, получивших инъекцию апротинина в дозе 2 мг/кг, был в 4,6 раза меньше, чем в контрольной группе, и практически не отличался от показателя Lздоровых¦ животных, не получавших морфин.

Таблица 1
| Отряхивание Lмокрой собаки¦ | |||||
| Встряхивание головой | |||||
| Встряхивания лапами | |||||
| Диспноэ | |||||
| Птоз | |||||
| Корчи | |||||
| Скрежет зубами | |||||
| Диарея |
Крысы,
которым внутрибрюшинно вводили сандостатин или N-Carboxymethyl-Phe-Leu
демонстрировали синдром отмены практически такой же выраженности,
как и у контрольных морфин-зависимых животных (рис. 1).
Предмет испытаний - структура и динамика опиатного абстинентного синдрома.
Контингент испытаний - 40 больных (29 - мужчины, 11 - женщины) наркоманиями опийной группы. Давность заболевания - от 2 до 5 лет. Группу сравнения составили 20 больных наркоманиями опийной группы, лечившихся по общепринятой методике.
Условия испытаний - стационарное лечение в отделении ¦5 ГНЦ наркологии МЗ РФ.
Методика испытаний - количественная
оценка симптоматики опиатного абстинентного синдрома в динамике
после однократного внутривенного капельного введения апротинина
гидрохлорида в дозах от 10000 до 30000 ед. При сохранении болезненной
симптоматики производили повторные введения препарата на 2 и 3
день.
У 14 больных отмечен купирующий эффект апротинина на абстинентную симптоматику, т. е. полное исчезновение болевых и других тягостных ощущений, включая сенестопатии, ознобы, чувство жара, потливость, тошноту, анорексию, бессонницу, беспокойство, неусидчивость, дисфорию, ипохондрию, назойливость, капризность и тягу к наркотику. Начальными проявлениями терапевтического действия препарата были успокоение, расслабление, восстановление нормальной окраски кожи лица, нормализация пульса и погружение в глубокий сон - еще до окончания внутривенной капельной инфузии. После сна продолжительностью от 2 до 6 часов отмечалось выравнивание настроения, улучшение аппетита, самочувствие становилось удовлетворительным. У 12 из 14 больных на следующий день алгические и вегетативные нарушения возобновлялись, но в значительно редуцированном виде (на 50-70%) и субъективно расценивались больными как Lтерпимые¦. В дальнейшем для их лечения было достаточным назначение обычных анальгетиков, вегетативно-стабилизирующих средств, транквилизаторов и снотворных.
У 17 больных из 40 после введения апротинина произошло значительное улучшение состояния, что проявлялось в ослаблении болезненной симптоматики на 50-60% по истечении первых суток. При этом Lнетерпимые боли¦ и мучительное недомогание превращались в летучие, нестойкие неприятные ощущения неопределенного характера (Lусталость в мышцах¦, Lзуд в костях¦ и др.) и чувство дискомфорта. Отмечалось исчезновение дисфории, назойливости, ажитации, восстанавливался аппетит. Однако оставались, хотя и в меньшей степени, подавленность, бессонница, ипохондрия и влечение к наркотику. Эти нарушения в дальнейшем сравнительно легко уступали действию антидепрессантов и нейролептиков. Сравнение терапевтического действия апротинина в дозе 10000 ед. с действием дозы 30000 ед., показало более выраженный терапевтический эффект более высокой дозы. В целом же данная подгруппа больных отличалась от предыдущей изначальным преобладанием в структуре абстинентного синдрома эмоциональной патологии, тесно связанной с влечением к наркотику.
У 9 больных из 40 введение апротинина либо оказало незначительное улучшение состояния, либо не привело к изменению симптоматики. Все эти больные изначально характеризовались преобладанием депрессивных, дисфорических, деперсонализационных, астено-депрессивных, диссомнических и психопатоподобных расстройств. Им сопутствовало сильное влечение к наркотику. Алгические и вегетативные компоненты абстинентного синдрома у больных этой группы были выражены неярко.
В группе сравнения (20 больных), судя по выраженности симптомов, приходящихся в среднем на одного больного, терапевтическая динамика алгических и вегетативных растройств была медленнее в 3,5 раза, эмоциональных и поведенческих нарушений - в 1,6 раза.
Каких-либо осложнений, ухудшения состояния больных в ходе лечения апротинином не отмечено.
Приведенные данные позволяют заключить, что применение апротинина для купирования абстиненции у больных опийной наркоманией окажется эффективным и безопасным средством патогенетической терапии. Апротинин может быть рекомендован как лекарственное средство для редукции алгических и вегетативных компонентов опийного абстинентного синдрома.
В начале 1998 года планируется выпуск в России лекарственной
формы, содержащей апротинин под названием Lнаркап¦, для использования
в наркологической практике.
The aim of the first part of this study was to investigate the action of the aprotinin (narkap) on severity of withdrawal syndrome in morphine-dependent rats ant to compare this action with influence of sandostatin and inhibitor of enkephalinases - N-Carboximethyl-Phe-Leu. It was shown, that aprotinin inhibit the opiate withdrawal in dose-dependent manner. Sandostatin, and N-Carboximethyl-Phe-Lew does not produce any action on withdrawal syndrome. This data show the possibility of the decreasing severity of withdrawal by action on peripheral system of peptide's catabolism.
The next part was the study
of the clinical effect of the aprotinin. 40 opiate-dependent patients
were observed in 5th Clinical departement of State
Research Center of Addictions. In most of patients, a single administration
of aprotinin significantly decreased or even fully inhibited withdrawal
symptoms. The data suggest that aprotinin may be perspective compound
for effective therapy of abstinent syndrome in opiate abusers.
Альтшуллер Владимир Борисович,
доктор мед.наук, профессор, заместитель директора ГНЦ наркологии
по науке, руководитель 5 клинического отделения ГНЦ наркологии
МЗ РФ. Врач, занимается проблемами лечения алкоголизма и наркоманий.
Судаков Сергей Константинович,
доктор мед.наук, руководитель лаборатории нейробиологии влечений
ГНЦ наркологии МЗ РФ. В настоящее время занимается исследованием
механизмов формирования зависимости и действия психоактивных веществ,
разработкой фармакотерапии наркоманий.