Ангиотензин-II (A-II) - октапептид, классический представитель нового класса биорегуляторов эндогенного происхождения. Данные о физиологической роли и фармакологических эффектах А-II многообразны и противоречивы. А-II (гипертензин и др.), применяемый в клинической практике является эффективным вазоконстриктором с кратковременным действием на уровне артериальных сосудов периферического кровяного русла. Самостоятельные физиологические функции А-II в рамках ЦНС связаны с его участием в формировании таких эмоционально окрашенных состояний, как боль, страх, жажда. Считают также, что А-II модулирует реакции эмоционального напряжения и стресса при хроническом неудовлетворении основных биологических потребностей [1, 2, 3]. Как это внешне ни парадоксально, но А-II обладает также и опиатоподобной активностью за счет жестких функциональных связей ренин-ангиотензиновой и опиатной систем мозга [4].
Дифференцированный подход к интерпретации фармакологических эффектов и специфической физиологической роли тех или иных биологически активных соединений (в т. ч. и А-II) был и продолжает оставаться актуальным. Успех в решении такого рода задач, находящихся в поле зрения нейрофизиолога-экспериментатора, может быть достигнут как на путях совершенствования методик исследований, так и при условии корректного использования методологических принципов анализа наблюдаемых явлений.
В отношении проблемы физиологической активности А-II весьма перспективными представляются методы изучения эффективности веществ-блокаторов специфических А-II рецепторов клеточных мембран, совершенствование и использование иммуннологических методик к оценке естественной, биологической роли вазоактивных пептидов и др. экспериментальные подходы. В методологическом плане разработанная П.К.Анохиным общая теория функциональных систем открывает уникальные перспективы анализа участия А-II в интегративной деятельности мозга. Известно, например, что потребность организма в воде лежит в основе формирования одной из основных биологических мотиваций - жажды. Удовлетворение жажды водой и устранение питьевой потребности представляют собой результат деятельности функциональной системы питьевого поведения и фактически являются системообразующими факторами.
В этой связи сравнительный анализ участия тех или иных метаболически активных химических соединений в центральных механизмах жажды должен оцениваться на Lвесах¦ равного результата деятельности организма при внутримозговой дипсогенной стимуляции этими веществами, определяемого по количеству потребленной воды в фиксированный интервал времени (например, при направленной активации ренин-ангиотензиновой и холинергической систем мозга). Признание этой необходимости и учет результативности поведения при внутримозговых вмешательствах открывает дополнительные возможности выявления специфического вклада холин- и пептидергической систем в многообразные варианты реализации целенаправленной активности организма в условиях искусственно вызванной жажды.
В наших опытах при стимуляции ренин-ангиотензиновой системы использовали А-II (50 нг в 1-3 мкл физ. раствора) и холинергической системы - карбахолин (КХ) в дозе 5 мкг в 1-3 мкл физ. раствора (внутрижелудочковые микроинъекции у бодрствующих крыс популяции LВистар¦). Было обнаружено, что внутримозговые вмешательства этими веществами в указанных дозировках сопровождались разными по выраженности питьевыми эффектами. Так, введение 5 мкг КХ вызывало у животных потребление воды в объеме 22,11,0 мл воды за 1 час наблюдения, в то время, как А-II в дозе 50 нг инициировал прием жидкости в объеме 3,40,4 мл за тот же период времени. В связи с этим в дальнейшем дозы КХ уменьшали, а А-II увеличивали, т. е. подбор равнорезультативных доз осуществляли методом Lножниц¦. В результате такого поиска было выявлено, что использование 0,5 мкг КХ и 0,4 мкг А-II вызывает потребление приблизительно одинаковых количеств воды (соответственно, 9,38,0 мл и 9,10,5 мл). На основании этого было сделано заключение о равнорезультативных дипсогенных эффектах найденных доз. Контрольные микроинъекции физиологического раствора воднонасыщенным животным вызывали у них потребление воды лишь в объемах 1,41,0 мл, что связано, по-видимому, с физическими артефактами внутримозгового вмешательства. Кроме того, обычная 1-суточная водная депривация сопровождалась у крыс последующим потреблением 14,72,4 мл жидкости, что позволяет говорить об относительной физиологичности эффектов действия КХ и А-II в указанных дозах.
В специальной серии экспериментов оценивали эффекты хемостимуляции мозга крыс равнорезультативными дипсогенными дозами КХ и А-II на фоне предварительной перекрестной блокады специфических внутримозговых хеморецепторов ренин-ангиотензиновой и холинергической систем. Это означает, что внутримозговое введение КХ проводили после блокады саралазином рецепторов А-II; соответственно, микроинъекции А-II осуществляли на фоне предшествующей блокады М-холино-рецепторов атропином. Дозы указанных блокаторов находились в пределах, отмеченных в авторитетных литературных источниках [5, 6], и 10-кратно превышали дозы КХ и А-II. В результате проведенных опытов было обнаружено не только увеличение числа питьевых поведенческих актов, но и дополнительных, не связанных с приемом воды форм поведения, специфичных для активации ренин-ангиотензиновой и холинергической систем (пищевая, ориентировочная, комфортная и др. формы поведения).
В ранних опытах нашей лаборатории было показано, что проявления какого-либо поведения при экзогенных воздействиях и моделировании эндогенных конфликтов не всегда отражают модальность (специфичность) формирующейся доминирующей мотивации. Примером экзогенных воздействий может послужить создание искусственных препятствий перед животными на пути их достижения цели для удовлетворения ведущих потребностей (например, при жажде).
В этом отношении экспериментальная модель, в которой крысы в ответ на специфическую хемостимуляцию мозга должны были осуществить определенную манипуляцию с педалью (ее нажатие) для последующего получения порции воды, является адекватным приемом изучения физиологического вклада ренин-ангиотензиновой и холинергической систем в реализацию сложного поведения, направленного на прием воды. При этом педаль можно рассматривать в качестве своеобразного физического препятствия на пути достижения животным результата целенаправленной деятельности. Поэтому в следующей серии экспериментов по характеру воспроизведения инструментальных навыков, а также по особенностям поведенческого Lаккомпанемента¦ (дополнительные формы активности) мы оценивали силу (интенсивность) питьевого мотивационного возбуждения, вызванного микроинъекциями равнорезультативных (в условиях свободного доступа к воде) доз А-II и КХ.
При анализе питьевого инструментального поведения было обнаружено, что латентные периоды воспроизведения приобретенных навыков в ответ на хемостимуляцию КХ по отношению к А-II были более продолжительными и составляли 5-30 с (КХ) и 0,5-2 с (А-II). Количества потребляемой воды в течение 1 ч. наблюдения было приблизительно равными (7,81,8 мл - КХ, 8,31,7 л - А-II). Эффективность питьевого инструментального поведения была достоверно (р<0,05) ниже при введении КХ по сравнению с А-II (89,11,1%% - KX; 93,00,8%% - A-II). Максимальное количество питьевых инструментальных актов при хемостимуляции КХ приходилось на более поздний, третий 5-минутный интервал наблюдения, по сравнению с хемостимуляцией А-II. Продолжительность инструментального поведения при микроинъекциях А-II была достоверно ниже. При стимуляции КХ наблюдалось большее количество проявлений ориентировочно-исследовательского (р<0,02) и пищевого (р<0,05) видов поведения. В течение ряда лет отстаивается точка зрения, что Lпаттерн¦ (рисунок) электрической активности нервных клеток головного мозга может служить критерием их вовлеченности в механизмы мотивации или подкрепления [7]. Возможно, данный показатель отражает и более общую биологическую закономерность включения систем разного уровня в указанные полярные состояния (мотивация - подкрепление).

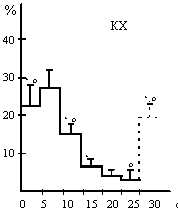
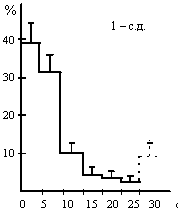
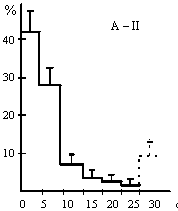
А-II - хемостимуляция ангиотензином-II;
КХ - хемостимуляция карбахолином;
1 с. д. - односуточная водная депривация;
по оси абсцисс - 5-секундные отрезки времени межактных интервалов;
по оси ординат - количество инструментальных актов, выраженных в %%
В наших экспериментах было обнаружено, что дипсогенная стимуляция А-II и 1-суточная водная депривация (контрольная серия опытов) инициируют инструментальную деятельность, Lпаттерны¦ которых практически совпадают, а доминирующие значения межактных интервалов (по аналогии с межимпульсными интервалами активности нервных клеток) приходятся на пределы от 0 до 10 с. Отмечено также, что Lпаттерны¦ питьевой инструментальной деятельности крыс, обусловленной микроинъекциями КХ, достоверно отличаются от двух вышеуказанных (рис. 1) и имеют более широкий разброс доминирующих значений межактных интервалов в пределах от 0 до 15 с. Это позволяет говорить о большей регуляризации ритма питьевой инструментальной деятельности при пептидергической стимуляции мозга по сравнению с холинергической. Нам представляется, что обнаруженная нами регуляризация ритма инструментальной деятельности проявляется на уровне целостного поведения, показывая более высокую успешность прогнозирования достижения результата питьевого целенаправленного акта при участии А-II. В этом отношении особое значение приобретают уже отмеченные выше свидетельства тесной функциональной связи ренин-ангиотензиновой системы мозга с опиоидной, играющей, как известно, ключевую роль в механизмах положительных эмоций и подкрепления.
Таким образом, активация ренин-ангиотензиновой системы по сравнению с холинергической равнорезультативными дозами (для условий свободного доступа к воде) сопровождается формированием мотивационного состояния большей интенсивности, обеспечивающего более высокую результативность не простых, а сложных инструментальных актов, их большую целеустремленность. В свою очередь, хемостимуляция мозга КХ характеризовалась в большей степени смещением поведенческой питьевой инструментальной активности в сторону реализации неадекватных внутренней потребности, ориентировочно-исследова-тельских и пищевых форм поведения. Это особенно ярко проявилось в своеобразном расширении поведенческого репертуара животных дополнительными формами активности животных в случаях необходимости для них преодоления физического препятствия (нажатие на педаль). Таким образом, А-II обеспечивал реализицию таких форм поведения, которые оказывались наиболее оптимальными и приспособительными в усложняющихся условиях внешней среды.
Влияние окружающей среды на поведение живого объекта, как известно, не ограничивается внешними факторами физической или химической природы. В процессе эволюции живого, помимо развития и совершенствования биологических объектов, происходило их объединение в биосоциальные группы, оказывающие, в свою очередь, огромное влияние на поведение каждой особи за счет обогащения форм взаимодействия между ними. В этой связи мы провели анализ влияния зоосоциального окружения, обеспечивающего возникновение биологических препятствий на пути реализации питьевого поведения, вызванного дипсогенной стимуляцией мозга крыс, конкурирующих в борьбе за воду (рис. 2). Исследовали поведение одной, отдельно выделенной внутри группы (15 групп крыс, по 3 животных в каждой) особи, которая занимала подчиненное положение в иерархической организации и находилась в конкурентных отношениях с другими в борьбе за получение порций воды.

Рис. 2. Схватка за порцию воды между отдельными особями, занимающими различное ранговое положение в группе Проведенные опыты позволили выявить усиление Lбойцовских¦ качеств низкоранжированных особей в случае пептидергической (А-II) хемостимуляции мозга, а в ответ на внутрижелудочковые введения КХ крысы демонстрировали, в основном, преобладание груминга и ориентировочно-исследова-тельской деятельности. Наличие или отсутствие Lбойцовских¦ качеств рассматривают как проявление силы (интенсивности) исходного мотивационного возбуждения, а преобладание дополнительных форм поведения свидетельствует о сбросе избытка специфической мотивационной энергии, в данном случае питьевой. Микроинъекции А-II при наличии биологических препятствий оказывали специфическое, оптимизирующее влияние на реализацию питьевого поведения (увеличение потребленной воды, в среднем, на 125-130%) и конкурентноспособность животных (увеличение числа побед в схватках за получение порций воды на 250-300%) в борьбе за воду. Мотивациогенная же стимуляция мозга животных КХ приводила в большей степени к трансформации исходного мотива деятельности в другие формы активности, не имеющей отношения к удовлетворению жажды (возрастание количества случаев груминга, пищевых актов, ориентировочно-исследовательской активности, в среднем, на 250-270%).
Предполагалось, что большая сила (интенсивность) питьевого мотивационного возбуждения, выявленная при активации пептидергических механизмов жажды на модели инструментального поведения должна была бы привести к большей трансформации и даже автономизации новых форм поведения (агрессивность, половая активность и др.) от питьевого в условиях зоосоциальной конкуренции за воду [9]. Однако полученные результаты свидетельствуют о противоположном ожидаемому участии А-II в организации питьевого поведения, обеспечивающем прагматическое подключение элементов агрессивного поведения при зоосоциальной конкуренции за воду с целью любым способом удовлетворить потребность в воде. Это говорит о более оптимизирующей роли А-II, по сравнению с другими метаболитами (например, ацетилхолина) в механизмах формирования жажды.
Описанный еще в 1908 г. и ставший классическим закон Иеркса-Доудсона
постулирует исключительную роль Lоптимума¦ мотивации в реализации
целенаправленной деятельности человека. Можно предположить, что
в создание этого Lоптимума¦ значительный вклад вносят эндогенные
регуляторные пептиды, в частности А-II, один из основных метаболитов
ренин-ангиотензиновой системы. Использование общей теории функциональных
систем академика П.К.Анохина в качестве методологической базы
исследования, особенно учет системообразующей роли результата
деятельности организма, еще на стадии постановки задач в настоящей
работе, как нам представляется, обеспечило высокую достоверность
высказанных предположений.
1. Гомазков О.А. Физиологически активные пептиды.- М.,1995.- 26 с.
2. Ролс Б., Ролс Э. Жажда.- М.: Медицина, 1984.- 192 с.
3. Судаков К.В. // Журнал ВНД имени И.П.Павлова.- 1987.- Т.37, ¦1.- С.78.
4. Summy-Long J. J.Pharmacol exp. Ther.- 1981.- V.2, ¦3.- P.630.
5. Simpson J. Brain Res.- 1972.- ¦45.- Р.135.
6. Nicoletta P. a. o. Neuropharmacology.- 1983.- ¦11.- Р.1269.
7. Журавлев Б.В. Нейрофизиологические механизмы опережающих
возбуждений в системной организации поведенческих актов: Автореферат
дисс. докт.... наук.- М., 1986.
The authors investigated the influence of eqally effective doses
of dipsogenic angiotensin-II (A-II) and carbachol (Cch) on rat's
behavior. The activation of renin-angiotensin system by intraventricular
A-II administration (microinjections) in comparison with Cch evoked
manifestation of more goal-directed character of drinking, including
special instrumental forms of behavior and zoosocial conflicts,
during struggle between individuals for water consumption. It
was suggested an exclusive role of peptidergic brain systems in
Loptimum¦ of dominant motivational excitation.
Котов Александр Владимирович, 1943 года рождения. Доктор
медицинских наук, профессор, заслуженный деятель науки Российской
Федерации, действительный член Международной Академии Наук. Окончил
в 1967 году 1 Московский медицинский Институт имени И.М.Сеченова
по специальности LЛечебное дело¦. С 1974 года последовательно:
ученый секретарь, заместитель директора по научной работе, руководитель
лаборатории мотиваций вновь созданного НИИ нормальной физиологии
имени П.К.Анохина АМН СССР. В настоящее время - руководитель лаборатории
мотиваций того же института, заведующий кафедрой нормальной физиологии
Института медицинского образования Новгородского Государственного
Университета имени Ярослава Мудрого. Основное научное направление
- изучение нейрохимических и молекулярных основ биологических
влечений в норме и их возможной трансформации в патологические
формы мотивационного возбуждения.
Шестаков Павел Анатольевич, 1958 года рождения, кандидат
медицинских наук. В 1981 году окончил 2 Московский медицинский
Институт имени Н.И. Пирогова. С 1982 по 1992 год - научный сотрудник
НИИ нормальной физиологии имени П.К.Анохина АМН СССР. В настоящее
время - старший научный сотрудник НИИ традиционных методов лечения
МЗ РФ. Область научных интересов - роль вазоактивных и опиоидных
пептидов в формировании и реализации целенаправленного поведения
у животных различного уровня эволюционного развития.