РАЗВИТИЕ ИДЕЙ И.П. ПАВЛОВА ОБ УЧАСТИИ ЛЕГКИХ В
РЕГУЛЯЦИИ ГЕМОСТАЗА
Ю. Ю. Бяловский* , В. Н. Морозов*, С. А. Шустова*
1. Введение
Термин "метаболические функции легких" появился сравнительно
недавно [17]. Установлено, что легкие участвуют в фильтрационной функции крови,
в поддержании агрегатного состояния крови, в водно-солевом и белково-жировом
обменах, в биотрансформации и метаболизме
биологически активных веществ и др. [7]. Однако еще в 1887 г.
И.П. Павлов обратил внимание на то, что кровь, оттекающая от легких,
свертывается медленнее, чем притекающая. Данный факт он объяснил поступлением
из легких в кровь веществ, тормозящих коагуляцию. Это позволяет утверждать,
что именно И.П. Павлов является основоположником учения о метаболических
функциях легких.
Легкие являются источником тканевого тромбопластина, факторов и активаторов противосвертывающей
системы (тучные клетки альвеол синтезируют до 70% гепарина в циркулирующей
крови), активно синтезируют простагландины, метаболизируют
фибриноген и извлекают из плазмы продукты деградации фибрина [14]. На
поверхности эндотелиальных клеток в сосудах легких обнаруживаются С-белок и a2-макроглобулин (a2MG). Получены экспериментальные данные о регулирующей
роли легких в процессах текучести крови [1]. В силу изложенного поиск путей и
способов целенаправленного воздействия на метаболические функции легких
составляет важную медицинскую проблему.
Целью исследования являлось изучение стимулирующего
действия дополнительного респираторного сопротивления (ДРС) на такую метаболическую
функцию легких, как поддержание адекватного агрегатного состояния крови.
2. Материалы
и методы
В исследованиях принимали участие 14 добровольцев, практически
здоровых лиц обоего пола, в возрасте 18-20 лет. Применялись инспираторные
резистивные дыхательные нагрузки, величина которых рассчитывалась, исходя из
величины нормального подмасочного давления во время
первого нагруженного вдоха при проведении пробы Мюллера (вдох при полностью
перекрытых воздухоносных путях). Зарегистрированное при этом давление
принималось за 100% (100%Pmmax),
а в опыте, во время действия резистивной нагрузки, с помощью специального
оригинального устройства [6] внутриротовое давление
поддерживалась на уровне 40% от 100%Pmmax.
Продолжительность воздействия составляла 3 мин. Забор венозной крови производился
до и сразу после предъявления резистивной нагрузки.
Состояние гемостаза оценивали по следующим показателям:
время рекальцификации плазмы (VR), концентрации фибриногена (KF),
растворимого фибрина (RF), продуктов
деградации фибрина (PDF), антитромбина III (AT3),
активатора плазминогена (AP), плазмина (P),
гепарина (G); производилось
определение суммарной фибринолитической активности
плазмы (SFA) [2], содержания a2-макроглобулина
и a1-антитрипсина
(a1AT) по
методическим рекомендациям фирмы "Boehringer Manncheim" (Германия) на анализаторе ФП-901 фирмы "Labsystem"
(Финляндия). Полученные данные обработаны с помощью автоматизированного статистического
пакета "Statgraphics
2.6".
3.
Полученные результаты
Изменения гемостатических
показателей в условиях ДРС представлены в табл. 1.
Таблица 1
Показатели гемостаза испытуемых до и во
время
воздействия дополнительного респираторного
сопротивления
40%Pmmax
|
Показатели гемостаза |
До нагрузки |
После нагрузки |
Рd |
|
Время
рекальцификации плазмы, с |
83,9 + 1,8 |
93 + 2,3 |
Р < 0,01 |
|
Концентрация
фибриногена, мкмоль/л |
10,6 + 0,1 |
10,6 + 0,08 |
P > 0,05 |
|
Концентрация
растворимого фибрина, мкмоль/л |
0,21 + 4,1 |
0,17 + 2,9 |
Р < 0,0001 |
|
Продукты
деградации фибрина, нмоль/л |
59,2 + 3,0 |
69 + 3,3 |
Р < 0,05 |
|
Концентрация
гепарина, Е/мл |
0,53 + 0,02 |
0,73 + 0,02 |
Р < 0,0001 |
|
Концентрация
антитромбина-III, % |
89,3 + 0,5 |
98,9 + 1,1 |
Р < 0,0001 |
|
Суммарная
фибринолитическая активность, мм2 |
48,6 + 1,6 |
59 + 1,7 |
Р < 0,001 |
|
Активатор
плазминогена, мм2 |
39,6 + 1,2 |
45,1 + 0,9 |
Р < 0,001 |
|
Концентрация
плазмина, мм2 |
9,0 + 0,4 |
13,9 + 0,9 |
Р < 0,0001 |
|
Концентрация
a2-макро-глобулина, мкмоль/л |
3,9 + 0,05 |
3,4 + 0,1 |
Р < 0,0001 |
|
Концентрация
a1-анти-трипсина,
мкмоль/л |
41,2 + 0,6 |
35,3 + 1,0 |
Р < 0,0001 |
|
I
фаза электрогоагулограммы, с |
209,1 + 23,8 |
307,2 + 38,3 |
P < 0,05 |
|
II
фаза электрогоагулограммы, с |
101,6 + 23,5 |
113,3 + 16,7 |
P > 0,05 |
|
III
фаза электрогоагулограммы, с |
743,0 + 9,6 |
668,7 + 70,5 |
P > 0,05 |
|
Общее
время свертывания,
с |
308,4 + 34,5 |
420,6 + 36,2 |
P < 0,05 |
Действие в течение 3-х мин. инспираторной резистивной
нагрузки сопровождалось повышением активности противосвертывающей
системы, о чем свидетельствует увеличение концентрации гепарина (p<0,0001) и антитромбина III (р<0,0001), уменьшение
концентрации a2-макроглобулина
(p<0,0001)
и a1-антитрипсина (p<0,0001),
увеличение времени рекальцификации плазмы крови (р<0,01).
Свидетельством повышения содержания активаторов плазминогена и снижения уровня ингибиторов фибринолиза является уменьшение в плазме концентрации
растворимых комплексов мономеров фибрина (p<0,0001), возрастание
концентрации активатора плазминогена (p<0,001) и
увеличение концентрации плазмина (p<0,0001). Кроме того, увеличивалась суммарная фибринолитическая активность плазмы (p<0,001) и возрастало
содержание продуктов деградации фибрина (p<0,05), что можно рассматривать
как следствие активации процесса фибринолиза. Следует
отметить, что содержание фибриногена в плазме крови не изменялось (р>0,05).
При анализе данных электрокоагулографического
исследования до и после предъявления резистивной нагрузки выявляется тенденция
к развитию гипокоагуляциoнного состояния: увеличение
I электрокоагулографической фазы (она отражает время
I и II фаз свертывания крови [9] -р<0,05) и увеличение общего времени свертывания (р<0,05). Длительность
II и III фаз электрокоагулограммы до и после предъявления
ДРС достоверно не различалась (р>0,05).
С целью выяснения реального влияния формируемых изменений
гемостатических показателей при кратковременном
воздействии резистивных дыхательных нагрузок анализ начинали со статистической
оценки матриц исходных данных по характеру распределения. Просчеты статистик
для оценки функции распределения (показатели ассиметрии
и эксцесса с ошибками и критериями надежности) позволили заключить, что
большинство физиологических параметров наблюдаемой нами объектной выборки имели
функции распределения, близкие к нормальным. Это обстоятельство дало
возможность оперировать показателями вариативности признаков (дисперсией) с
целью учета влияния контролируемых (организованных) и неконтролируемых
(неорганизованных) входных факторов.
В качестве контролируемого фактора использовалась величина
резистивной нагрузки, а в качестве показателей деятельности - показатели
гемостаза: время рекальцификации плазмы, концентрация
фибриногена, а также растворимого фибрина, продуктов деградации фибрина, антитромбина-III, активатора плазминогена
и плазмина, гепарина, содержание a2-макро-глобулина
и a1-антитрипсина,
суммарная фибринолитическая активность плазмы.
Полученные в ходе однофакторного дисперсионного анализа данные представлены на
рис. 1.
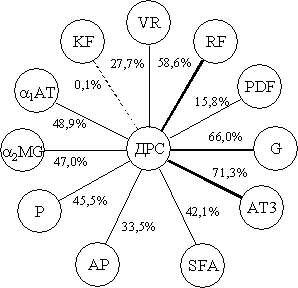
Рис. 1. Показатели влияния организационного фактора (%)
дополнительного респираторного сопротивления на
параметры гемостаза (обозначения параметров в тексте)
Как следует из представленных данных, все
анализируемые показатели, кроме концентрации фибриногена, испытывали достоверно
сильное влияние (pF<0,05)
со стороны организованного фактора ДРС. Наиболее значительный факторный отклик
отмечался со стороны концентрации антитромбина-III
(71,3%) и гепарина (65,9%), существенное влияние испытывали уровни растворимого фибрина (58,6%), a1-антитрипсина (48,9%), a2-мак-роглобулина (47,3%), суммарной фибринолитической
активности плазмы (42,1%), плазмина (45,5%). Менее сильное влияние оказывали
время рекальцификации плазмы (27,7%), концентрация
активатора плазминогена (33,5%) и продуктов
деградации фибрина (15,8%). Концентрация фибриногена не испытывала влияния со
стороны организованного фактора (pF>0,05).
Проведенный дисперсионный анализ позволяет предположить,
что изменения большинства рассматриваемых показателей гемостаза испытывают
существенное влияние со стороны дополнительного респираторного сопротивления.
С целью определения структуры связей в системе
гемостаза в исходном состоянии и после действия ДРС мы осуществляли построение
корреляционных плеяд [8] (рис. 2 и 3).
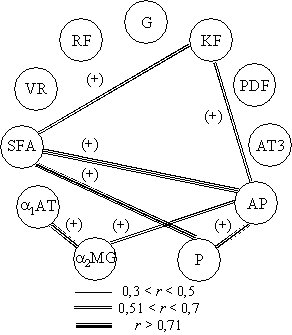
Рис. 2. Корреляционная плеяда показателей гемостаза до
предъявления дополнительного респираторного
сопротивления 40%Pmmax
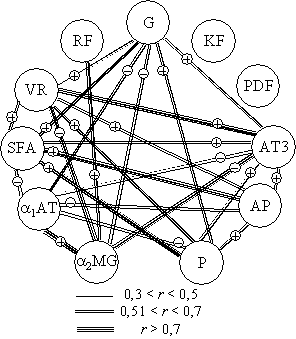
Рис. 3. Корреляционная плеяда показателей гемостаза после
предъявления дополнительного респираторного сопротивления 40%Pmmax
Как следует из представленных в рисунках данных,
корреляционная плеяда показателей гемостаза до предъявления ДРС характеризовалась
наличием умеренного числа корреляционных связей, преимущественно между
показателями противоствертывающей системы (суммарная
фибринолитическая активность, активатор плазминогена, плазмин, a2-макроглобулин, a1-ан-титрипсин). Показатели коагуляционного
потенциала не демонстрировали сопряженных связей между собой и параметрами противосвертывающей системы. В соответствии с идеологией
корреляционного анализа подобное распределение связей свидетельствует о низком
напряжении в системе гемостаза, когда отдельные элементы системы мало
содействуют друг другу в силу значительных функциональных резервов. Иная
картина наблюдалась в группе испытуемых после предъявления ДРС (рис. 3). Здесь
отмечался рост числа и тесноты (силы) корреляционных связей между
взаимодействующими элементами. Это, по-видимому, обусловлено увеличением
напряжения в системе гемостаза и взаимодействием ее элементов с элементами других
систем. В сопряженный механизм взаимодействия вовлекаются новые элементы системы
гемостаза, что означает рост замещающей (компенсационной нагрузки) на элементы
смежных систем.
Изменения метаболических функций легких происходят
вследствие нарушения легочной вентиляции, прежде всего гиповентиляции,
а также при расстройстве кровообращения в легких, что характерно для различных
заболеваний легких. Особенности показателей гемостаза в легочном звене были
описаны у больных туберкулезом, раком легкого, хроническими неспецифическими
заболеваниями легких. Показано, что у больных хронической пневмонией I и II
стадий повышены концентрации фибриногена и уровень антитромбинов,
но заторможен фибринолиз [11]; первично развивается гиперкоагуляция, а вторично - гипокоагуляционные
сдвиги, нарастающие по мере прогрессирования сердечной недостаточности [14]. У
больных раком легких также оказывалась сниженной способность к коагуляции.
Наблюдалось изменение агрегационной способности крови, усиление активности противосвертывающей системы крови, снижение ее вязкости и
повышение текучести после прохождения крови через легкие при экспериментальной
острой пневмонии [1]. Гипокоагуляция и активация фибринолиза отмечались в условиях выраженной легочной
недостаточности, что связывалось с повышением концентрации активаторов
плазмина и снижением уровня ингибиторов фибринолиза,
а также с ростом в кровотоке растворимых комплексов мономеров фибрина [12]. У
больных с декомпенсированным легочным сердцем мощное антикоагулянтное действие обуславливалось действием
гипоксии на метаболизм ферментов, участвующих в свертывании крови [15].
Кратковременное (в течение 3-х минут) воздействие резистивной
дыхательной нагрузки 40%Pmmax,
вызывало гипокоагуляцию с активацией фибринолиза. Гипокоагуляция на
фоне ДРС, по-видимому, не связана с потреблением факторов свертывания (не происходит
резкого уменьшения концентрации фибриногена). Мы предположили, что инспираторная
резистивная нагрузка вызывает активную резорбцию факторов противосвертывающей
системы в общий кровоток за счет баропривной
гиперемии легких, которая развивается во время вдоха [18]. В этих условиях
увеличение антикоагулянтной активности крови следует
расценивать как защитную реакцию организма, направленную против блокады
сосудов микроциркуляции в условиях баропривной гиперемии.
4.
Заключение
Открытый И.П. Павловым факт участия легких в
регуляции гемостаза может служить теоретической основой для осуществления
практических мероприятий по целенаправленному управлению агрегатным состоянием
крови. Анализ результатов, полученных в настоящем исследовании, позволяет рекомендовать
практическое использование инспираторных резистивных нагрузок для повышения противосвертывающей активности системы крови. Известные
способы антикоагулянтной терапии, состоящие в применении
фармакологических препаратов, повышающих активность противосвертывающей
системы крови, могут иметь побочные явления в виде непереносимости рядом
пациентов лекарственных веществ. Кроме того, они сравнительно дороги, т.к.
требуют расхода лекарственных веществ и средств для их введения. Данный способ
рекомендуется практически здоровым лицам для улучшения микроциркуляции
крови, например, в тренировочном процессе спортсменов, в профессиональной
подготовке специалистов с повышенными стрессогенными
воздействиями (пожарные, спасатели и др.).
Литература
1. Александров
О.В, Райбман В.Н., Гришин В.Л. Роль легкого в становлении
реологических свойств крови // Пат. физиол. и эксперим.
терап.- 1982.- N 5.- С.17-20.
2. Балуда В.П., Баркаган З.С., Гольдберг Е.Д. и др. Лабораторные методы
исследования системы гемостаза.- Томск, 1980.- 333 с.
3. Бокарев И.Н.
Хроническое внутрисосудистое свертывание в клинике внутренних болезней: Автореф. дис.... докт. мед. наук.- М., 1980.- 42 с.
4. Бреслав И.С., Исаев
Г.Г. Реакция кардиореспираторной системы на
увеличенное сопротивление дыханию // Успехи физиологических наук.- 1991.-
Т.22, N 2.- С.3-18.
5. Бреслав И.С., Глебовский
В.Д. Регуляция дыхания.- Л.: Наука,
1981. - 280 с.
6. Бяловский Ю.Ю.,
Абросимов В.Н. Пневматический дозатор внешнего сопротивления дыханию //
Описание изобретения к патенту Российской Федерации N 2071790, зарег.20.01.97
7. Дубилей П.В., Уразаева З.В., Хамитов Х.С. Барьерная функция легких и
обеспечение гомеостаза.- Изд. Казанск. ун-та, 1987.-
192 с.
8. Завьялов А.В. Соотношение
функций организма.- М.: Медицина, 1990.- 160 с.
9. Коблов Л.Ф. Методы
и приборы для исследования гемостаза.- М.: Медицина, 1975.- С.149.
10. Коренюк В.А.,
Самсонова Т.И. Состояние ферментных систем легочной ткани / В кн.
Физиология и патология системы гемостаза.- Чита, 1980.- С.23.
11. Кузник Б.И., Красик Я.Д. и др. Универсальный характер коагулопатий
при различных заболеваниях / В кн.
Физиология и патология системы
гемостаза.- Чита, 1980.- С.95-104.
12. Макаревич
А.Э. Реакции системы гемостаза в ходе прогрессирования хронического бронхита // Пульмонология.- 1992.-
N 1.- С. 34-39.
13. Павлов
И.П. Полн. собрание соч.
Т. 1.- М.-Л.: Изд-во АН СССР, 1951.- 451 с.
14. Проблемы
и гипотезы в учении о свертывании крови / Под ред. Гаврилова О.К.-
М., 1985.- 288 с.
15. Раби К. Локализованная
и рассеянная внутрисосудистая коагуляция.- М., 1974.- 247 c.
16. Чучалин А.Г.
Бронхиальная астма.- М.: Медицина, 1985.- 160 с.
17. Heinemann H.O., Fishman A.R. Nonrespiratory functions of mammalian lung // Physiol. Rev.- 1969.- Vol.49.- P.2-47.
18. Olgiati R., Tcheoc G., Gerreteli R. Haemodynamic
effects of resistive breathing // Y.Appl. Physiol.- 1986.- Vol. 60, ¹ 3.- P. 846-853.
Development
of Pavlov I.P. Conception about the Lungs Participation in Regulation of
Hemostasis
Yu.
Yu. Byalovskiy, V.
Summary
Opened by I.P.Pavlov the fact
about the lungs participation in regulation of hemostasis
is the theoretical basis for realization of practical activity on goal-directed
control of blood state. The results of this researchs
allow to recommend a practical using of inspiratory
resistance loadings for a rise of anticoagulative
blood system activity.
|
|
Шустова Светлана Александровна, окончила Рязанский медицинский институт в
1984 г. С 1988 г. - ассистент кафедры патофизиологии Рязанского госмедуниверситета им. акад. И.П. Павлова. Автор 8 научных
работ. Сфера научных интересов - изменения системы гемостаза в условиях
респираторных нагрузок.
Бяловский Ю.Ю.,
Морозов В.Н. см. "ВНМТ", 1999, N 1